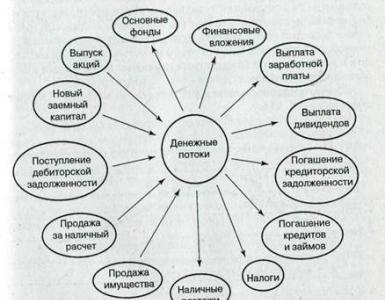
Роль фельдшера в лечении гипертонической болезни. Выпускная квалификационная работа
Артериальная гипертония – это негативное последствие научно-технического прогресса, которое все чаще встречается среди людей работоспособного возраста и характеризуется стойким повышением артериального давления (от 140/90 мм рт. ст. и выше).
Верхний показатель определяет систолическое давление, которое формируется вследствие сокращения сердечных стенок. Нижний показатель являет собой диастолическое давление, создаваемое сопротивлением периферических сосудов при расслаблении сердечной мышцы.
Этиология заболевания
В развитии гипертензии значительную роль играют факторы риска, общие для всех патологий системы кровообращения. Курение, алкоголь, стрессы, лишний вес и малоподвижный образ жизни способствуют нарушению обмена веществ, что негативно влияет на работу человеческого организма. Не стоит забывать о важности генетических факторов, так как они являются ведущими в развитии эссенциальной формы гипертензии.
Гипертоническая болезнь может быть вызвана различными причинами:
- воспалительные процессы в ЦНС (энцефалит, менингит, полиомиелит);
- эндокринные нарушения (ожирение, климакс, опухоли надпочечников и гипофиза);
- проблемы в работе почек (гломерулонефрит, пиелонефрит, поликистоз);
- сердечно-сосудистые болезни (атеросклероз, тромбоз, системный васкулит).
Вторичная форма возникает на фоне нарушения функционирования других систем организма. Например, смерть при гипертонической болезни может возникнуть вследствие почечной недостаточности. Иногда целенаправленное лечение основной болезни может привести к нормализации АД.
Развитие недуга
Патогенез гипертензии может различаться в зависимости от происхождения болезни. При эссенциальной (первичной форме) изменяются непосредственно сосуды, поэтому определить причину повышения давления зачастую бывает очень сложно. Симптоматическая (вторичная) форма недуга возникает вследствие нарушения работы различных систем организма.
Существует несколько механизмов развития артериальной гипертонии:
- Нервный. Длительное психоэмоциональное напряжение приводит к истощению центров сосудистой регуляции в ЦНС, так как при этом задействуются рефлекторные и гуморальные факторы.
- Почечный. Почка осуществляет баростатическую функцию (поддерживает уровень систолического АД) с помощью сложного механизма обратной связи, в которой задействуются рецепторы, гормоны и центральная нервная регуляция.
- Наследственный. Из-за генетического дефекта клеточных мембран возникает нарушение распределения внутриклеточного кальция, в результате чего сокращаются артериолы, что приводит к повышению артериального давления.
- Рефлекторный и гормональный. Роль нервно-гуморальной регуляции основана на деятельности прессорных и депрессорных факторов. Активация симпатической нервной системы в ответ на стресс приводит к повышению артериального давления.
Злокачественное течение недуга приводит к частым гипертоническим кризам, что характеризуются некрозом сосудистой стенки и образованием тромбов. Смерть от гипертонической болезни может наступить вследствие патологических изменений в кровеносном русле, что со временем приводят к ишемии, инфарктам, внутренним кровоизлияниям.
Доброкачественная форма артериальной гипертонии проявляется кратковременным спазмом сосудов. При дальнейшем течении болезни происходит распространение патологических изменений сосудов (атеросклероз, кардиосклероз). Последняя стадия артериальной гипертонии очень опасна, так как при ней возникают вторичные изменения внутренних органов. Иногда это смертельно опасно.
Основные симптомы
Болезнь может проявляться по-разному, в зависимости от:
- формы (доброкачественная и злокачественная);
- стадии (I – компенсированная, II и III имеют неблагоприятное течение);
- возраста пациента (пожилые люди переносят недуг тяжелее);
- метеорологической картины (возможно повышение АД перед дождем, снегопадом, резким изменением погоды);
- степени усталости (недосып, злость, нервное напряжение ухудшают состояние сердечно-сосудистой системы).
Смерть от гипертонической болезни может наступить внезапно. Скрытые патологические изменения сосудов иногда приводят к сердечному приступу, инфаркту, острой сердечной недостаточности. У некоторых людей повышение артериального давления обнаруживается только при его случайном измерении. Другие пациенты ощущают все негативные признаки заболевания. К ним относятся:
- частые головные боли, возникающие повторно после окончания действия анальгетиков;
- «мушки» перед глазами, нарушение зрения, сухость и неприятные ощущения в области надбровных дуг;
- головокружения, обмороки, нарушение координации движений;
- постоянное чувство усталости, нежелание работать, ухудшение состояния после физической деятельности, сидения за компьютером.
При длительном течении заболевания возможно присоединение осложнений. Сердце вынуждено работать в усиленном режиме, поэтому гипертоническая болезнь иногда сопровождается тахикардией, аритмией, болевыми ощущениями за грудиной, одышкой. Состояние значительно ухудшается после употребления кофеина, алкоголя, курения. Тогда больной может потерять сознание или слечь из-за резкой головной боли.
Многие люди списывают проблемы с давлением на утомление, стрессы, напряженную работу. Если симптомы присутствуют в течение длительного времени, необходимо срочно посетить врача. Это может указывать на артериальную гипертензию.
Причины смерти
Смертность от сердечно-сосудистых заболеваний в двадцать первом веке занимает первое место. Четверть жителей планеты не доживают до шестидесятилетия, а десятая их часть – умирает, едва достигнув порога в 30 лет. Причина смерти чаще всего заключается в сердечных приступах, ишемии миокарда, гипертоническом кризе. Проблемы с эластичностью сосудистой стенки, наличие тромбов, длительный спазм сосудов – это неблагоприятные факторы, в основе которых может лежать артериальная гипертензия.
Негативное влияние повышенного АД на организм:
- При гипертонии увеличивает риск возникновения инсульта, ишемии миокарда, склерозирования почечных артерий, особенно у пожилых людей.
- Вместе с курением и гиперхолестеролемией повышенное артериальное давление составляет триаду факторов риска развития атеросклероза.
- Длительный спазм сосудов может привести к сгущению крови и повышенному тромбообразованию.
- Снижение работоспособности вплоть до проблем с трудоустройством. Постоянные головные боли, потемнение в глазах, слабость и напряжение значительно сказываются на деятельности человека.
Без своевременного лечения пациенты, страдающие от артериальной гипертензии, имеют значительный риск возникновения осложнений, несовместимых с жизнью.
Смерть от гипертонической болезни может наступить вследствие таких патологических состояний:
- Левожелудочковая сердечная недостаточность.
- Инфаркт миокарда.
- Ишемический или геморрагический инсульт.
- Почечная недостаточность.
Это клинико-морфологические формы такого недуга. Сердечные, мозговые и почечные изменения возникают вследствие нарушения работы кровеносной системы. Чтобы избежать осложнений, необходимо следить за ежедневным уровнем АД, придерживаясь врачебных рекомендаций.
Профилактика и терапия
Методика лечения должна подбираться индивидуально в зависимости от сложности заболевания и присутствия дополнительных симптомов. В некоторых случаях можно обойтись без медикаментов, так как легкая степень болезни корректируется изменением образа жизни. При тяжелых состояниях рекомендации касательно рационального питания, физических нагрузок и режима дня стоит дополнить лекарственными препаратами подходящей фармакологической группы.
Среди лекарств от гипертонии выделяют пять основных групп:
- бета-адреноблокаторы («Анаприлин», «Атенолол», «Небиволол»);
- блокаторы кальциевых каналов («Нифедипин», «Амлодипин»);
- диуретики («Гидрохлортиазид», «Индапамид»);
- блокаторы ангиотензиновых рецепторов («Лозартан»);
- ингибиторы АПФ («Кептоприл», «Эналаприл», «Лизиноприл»).
Пациенты, которые лечатся с помощью антигипертензивных средств, должны проходить электрокардиограмму ежемесячно, а также контролировать состояние кровеносного русла (уровень липидов, кальция, глюкозы). Длительное применение этих средств может провоцировать депрессию и астению, поэтому необходимо оценивать активность пациента, его настроение, уровень работоспособности.
Характеристика препаратов
Каждая группа лекарственных средств имеет свои особенности:
- Бета-адреноблокаторы. Они являются традиционными в лечении артериальной гипертензии. Применение их на сегодня ограничено, так как, помимо эффективности, эти средства имеют много побочных эффектов. Они также применяют в лечении аритмии и для профилактики повторного приступа инфаркта миокарда.
- Блокаторы кальциевых каналов имеют длительное действие, поэтому назначаются пациентам с тяжелым течением гипертонической болезни. Из-за дефицита кальция возможны периферические отёки, астения, нарушение пищеварения, тахикардия.
- Диуретики используются в комплексном лечении гипертензии. Они помогают организму избавиться от излишней жидкости, уменьшить объем циркулирующей крови, что приводит к снижению нагрузки на сердце. Большинство диуретиков вымывают калий из организма, поэтому необходимо компенсировать его недостаток продуктами питания.
- Антагонисты ангиотензиновых рецепторов блокируют рецепторы в стенке артерий, уменьшая сосудистый спазм. В связи с этим уровень артериального давления постепенно снижается.
- Ингибиторы ангиотензинпревращающего фермента блокируют фермент, принимающий участие в синтезе сосудосуживающего вещества ангиотензина II.
Легочная гипертензия: симптомы и лечение, опасности заболевания
Описание болезни, ее причины
Гипертензия легочной артерии формируется на фоне других болезней, у которых могут быть совершенно разные причины возникновения. Развивается гипертензия в связи с разрастанием внутреннего слоя легочных сосудов. При этом происходит сужение их просвета и сбои в кровоснабжении легких.
К основным заболеваниям, которые приводят к развитию это патологии, относятся:
- хронический бронхит;
- фиброз ткани легких;
- врожденные пороки сердца;
- бронхоэктаз;
- гипертония, кардиомиопатия, тахикардия, ишемия;
- тромбозы сосудов в легких;
- альвеолярная гипоксия;
- повышенный уровень эритроцитов;
- спазмы сосудов.
Существует также ряд факторов, которые способствуют возникновению легочной гипертензии:
- болезни щитовидной железы;
- интоксикация организма ядовитыми веществами;
- длительный прием антидепрессантов или препаратов, угнетающих аппетит;
- употребление наркотических веществ, принимаемых интраназальным путем (вдыханием через нос);
- ВИЧ-инфекции;
- онкологические заболевания кровеносной системы;
- цирроз печени;
- генетическая предрасположенность.
Симптоматика и признаки
В начале своего развития легочная гипертензия практически никак себя не проявляет, в связи с чем пациент может не обращаться в больницу вплоть до наступления тяжелых стадий болезни. Нормальное систолическое давление в легочных артериях составляет 30 мм.рт.ст, а дистолическое – 15 мм.р.ст. Ярко выраженные симптомы появляются лишь тогда, когда эти показатели повышаются в 2 раза и больше.
На начальных этапах болезнь может быть выявлена на основании следующих симптомов:
- Одышка. Это главный признак. Она может возникать внезапно даже в спокойном состоянии и резко усиливаться при минимальной физической активности.
- Снижение веса, которое происходит постепенно, вне зависимости от рациона питания.
- Неприятные ощущения в животе – его будто распирает, все время чувствуется необъяснимая тяжесть в области живота. Этот симптом свидетельствует о том, что в воротной вене начался застой крови.
- Обмороки, частые приступы головокружения. Возникают в результате недостаточного снабжения кислородом головного мозга.
- Непрекращающаяся слабость в теле, ощущение бессилия, недомогания, сопровождающиеся подавленным, угнетенным психологическим состоянием.
- Частые приступы сухого кашля, хриплый голос.
- Учащенное сердцебиение. Возникает в результате недостатка кислорода в крови. Объем кислорода, необходимый для нормальной жизнедеятельности, в этом случае поступает только при учащенном дыхании либо повышении частоты сердечных сокращений.
- Расстройства кишечника, сопровождающиеся повышенным газообразованием, рвотой, тошнотой, болями в животе.
- Болевые ощущения с правой стороны тела, под ребрами. Свидетельствуют о растяжении печени и увеличении ее в размерах.
- Боли сжимающего характера в районе грудной клетки, чаще возникающие во время физических нагрузок.
На более поздних стадиях легочной гипертензии появляются следующие симптомы:
- При кашле выделяется мокрота, в которой присутствуют кровяные сгустки. Это свидетельствует о развитии отека в легких.
- Сильные боли за грудиной, сопровождающиеся выделением холодного пота и паническими приступами.
- Сбои сердечного ритма (аритмия).
- Болезненность в районе печени, возникающая вследствие растяжения ее оболочки.
- Скопление жидкости в полости живота (асцит), сердечная недостаточность, обширная отечность и посинение ног. Данные признаки свидетельствуют о том, что правый желудочек сердца перестает справляться с нагрузкой.
Для терминальной стадии легочной гипертензии характерны:
- Образование тромбов в легочных артириолах, что вызывает удушье, разрушение тканей, инфаркты.
Острые отеки легких и гипертонические кризы, которые возникают обычно в ночное время. При этих приступах больной испытывает резкую нехватку воздуха, задыхается, кашляет, при этом выхаркивая мокроту с кровью.
Кожа синеет, яремная вена выражено пульсирует. В такие моменты больной испытывает страх и панику, он чрезмерно возбужден, его движения хаотичны. Такие приступы обычно заканчиваются летальным исходом.
Диагностирует заболевание кардиолог. Обращаться к врачу необходимо при первых признаках болезни: сильная одышка при обычных нагрузках, боли в груди, постоянная усталость, появление отеков.
Диагностика
При подозрении на легочную гипертензию, кроме общего осмотра и пальпации на предмет увеличенной печени, врач назначает следующие обследования:

- ЭКГ. Выявляет патологии в правом желудочке сердца.
- КТ. Позволяет определить размер легочной артерии, а также другие болезни сердца и легких.
- Эхокардиография. В процессе этого обследования проверяется скорость движения крови и состояние сосудов.
- Измерение давления в легочной артерии путем введения катетера.
- Рентгенография. Выявляет состояние артерии.
- Анализы крови.
- Проверка влияния физической нагрузки на состояние пациента.
- Ангиопульмонография. В сосуды вводят красящее вещество, которое показывает состояние легочной артерии.
Только полный комплекс обследований позволит поставить точный диагноз и определиться с дальнейшим лечением.
Узнайте о заболевании больше из видео-ролика:
Методы терапии
Легочная гипертензия достаточно успешно поддается лечению, если болезнь еще не перешла в терминальную стадию. Врач назначает лечение в соответствии со следующими задачами:
- определение причины болезни и ее устранение;
- понижение давления в легочной артерии;
- предотвращение образования тромбов.
Медикаментозная
В зависимости от симптоматики, назначают следующие средства:

- Сердечные гликозиды – например, Дигоксин. Улучшают кровообращение, снижают вероятность развития аритмии, благоприятно влияют на работу сердца.
- Препараты для снижения вязкости крови – Аспирин, Гепарин, Герудин.
- Сосудорасширяющие средства, которые расслабляют стенки артерий и облегчают ток крови, благодаря чему понижается давление в артерии легкого.
- Простагландины. Предотвращают спазмы сосудов и образование тромбов.
- Мочегонные препараты. Позволяют вывести из организма излишки жидкости, тем самым сократив отечность и снизив нагрузку на сердце.
- Муколитики – Мукосольвин, Ацетилцистеин, Бромгексин. При сильном кашле облегчают отделение слизи из легких.
- Антагонисты кальция – Нифедипин, Верапамил. Расслабляют сосуды легких и стенки бронхов.
- Тромболитики. Растворяют сформировавшиеся тромбы и предотвращают образование новых, а также улучшают проходимость кровеносных сосудов.
Операции
При малой эффективности медикаментозного лечения врачом ставится вопрос о проведении хирургического вмешательства. Операции при легочной гипертензии бывают нескольких типов:
- Межпредсердное штудирование.
- Трансплантация легкого.
- Сердечно-легочная трансплантация.
Помимо назначенных врачом методов лечения легочной гипертензии для успешного выздоровления пациент должен соблюдать некоторые рекомендации: полностью отказаться от курения или наркотических средств, снизить физические нагрузки, не сидеть на одном месте больше двух часов в день, исключить или снизить до минимума количество соли в рационе питания.
Успех хирургического лечения зависит от многих обстоятельств. Хирургическое лечение нередко дает хороший результат лишь в тех случаях, когда помощь бывает оказана в начале заболевания. Поэтому понятна необходимость знания ранних симптомов хирургических заболеваний фельдшерами, к которым нередко прежде всего обращается больной.
Кроме того, вследствие быстроты течения и опасности для жизни многих хирургических заболеваний необходимо принятие срочных мер.
Медицинский работник любой специальности и любой квалификации должен знать эти меры. К ним относится, например, помощь при ранениях, при кровотечениях, при всевозможных повреждениях и т. д.
Во многих случаях хирургическое лечение дает хороший результат лишь тогда, когда первая помощь, которую часто оказывает фельдшер, была правильной и были приняты меры для предохранения больного от возможных осложнений.
Успех хирургического лечения зависит не только от оперирующего врача, но и от организации хирургической работы, от деятельности медицинского персонала, принимающего участие в операции и в подготовке к ней. Громадное значение, как мы увидим дальше, имеет подготовка больного к операции, производимая обычно средним медицинским персоналом.
Для больных с хирургическими заболеваниями, нередко находящихся в буквальном смысле слова между жизнью и смертью, особенно после тяжелых операций, имеет громадное значение уход. Даже, казалось бы, очень хорошо сделанная операция при недостаточном послеоперационном уходе может дать плохой результат. Хороший уход за больным, облегчающий его состояние, предупреждает всевозможные осложнения после операции, нередко очень опасные, а наблюдение за больным дает возможность своевременно оказать ему помощь. Очень важно своевременно подметить изменения в состоянии больного при внутреннем кровотечении после операции; нередко только быстро принятые меры могут спасти жизнь такого больного.
Таким образом, роль среднего медицинского персонала, в частности фельдшера, при хирургических заболеваниях весьма ответственна. Это относится к работе в хирургических отделениях и в особенности к самостоятельной работе фельдшера на участке.
Отсюда понятна необходимость знакомства медицинского персонала с основными вопросами хирургии, с важнейшими хирургическими заболеваниями, их лечением и экстренной помощью.
Особенно ответственной является работа фельдшера в области хирургии на сельском фельдшерско-акушерском пункте. Фельдшер оказывает первую доврачебную медицинскую помощь при острых заболеваниях (кровотечениях и несчастных случаях, ранениях) и в зависимости от состояния больного тут же вызывает врача к больному или направляет его в участковую или районную больницу или амбулаторию; в необходимых случаях сопровождает больного лично. Фельдшер своевременно направляет в участковую больницу (амбулаторию) больных с невыясненным диагнозом, а также с заболеваниями, требующими врачебного вмешательства; он отбирает больных, установление диагноза у которых затруднено, для консультации к приезду врача, способствует выявлению онкологических больных и по назначению врача обеспечивает их лечение. Фельдшер с разрешения здравотдела выдает больничные листы хирургическим больным.
В обязанности фельдшера входит работа по профилактике травматизма. При составлении отчета он должен анализировать причины травматизма.
Фельдшер участвует в работе общественного актива здравоохранения и местной первичной организации общества Красного Креста и Красного Полумесяца по организации санитарных постов в бригадах и звеньях колхозов, МТС, совхозов, леспромхозов, торфопредприятий и т. д.
По плану, утвержденному главным врачом участковой больницы, фельдшер ведет санитарно-просветительную работу, активно участвует в диспансеризации населения, отбирает контингента, подлежащие освидетельствованию врачом, проводит динамическое наблюдение и контроль за правильным применением трудовых рекомендаций. Он проводит назначенные врачом оздоровительные мероприятия, ведет разъяснительную работу о целях и задачах оздоровления труда и быта, проводит учет и выявление длительно болеющих, обеспечивает своевременную явку подлежащих диспансерному наблюдению, помогает в трудоустройстве инвалидов и следит за режимом их труда.
«Вольский медицинский колледж им. З.И. Маресевой»
Лёксина Оксана Николаевна
Студентка 4 курса, 141 группа
Роль фельдшера ФАП в профилактике рака шейки матки
Выпускная квалификационная работа
по специальности «Лечебное дело» (квалификация - фельдшер)
Научный руководитель
преподаватель Кочетова В.В.
2016 г.
Введение..................................................................................................................3
Глава 1 Распространенность онкогинекологических заболеваний............................................................................................................5
1.1 Частота ЗНО РФ и ПФО………………………………………......................5
1.2 Онкогинекологические заболевания в структуре всех ЗНО………………
1.3 Пути совершенствования ранней диагностики ЗНО………………………
Глава 2. Анализ частоты онкогинекологической патологии в Ульяновской области…………………………………………………………………………….
2.1 Частота ЗНО в Ульяновской области…………………………………………
2.2 Онкологические заболевания в структуре ЗНО Ульяновской области….
2.3 Проблемы ранней диагностики онкогинекологии…………………………..
Заключение
Список использованной литературы
Приложение 1 Статистические данные о раке шейки матки в РФ
Приложение 2 Алгоритм «Взятие мазка на цитологическое исследование»
Введение
По данным Росстата, ежегодно в России диагноз рак ставится порядка 500 000 человек, а смертность от онкологических заболеваний остается на втором месте в структуре смертности после сердечно-сосудистых заболеваний. Актуальность решения этой проблемы стала приоритетной и снижение смертности от онкологических заболеваний поставлено в ряд задач государственного масштаба. Онкологические заболевания являются основн ыми причинами инвалидизации и смерти в развитых и многих развивающихся странах мира, ежегодно унося большее число жизней, нежели суммарно все остальные причины смерти. По мере снижения уровня смертности и роста продолжительности жизни в странах, находящихся на более поздних этапах эпидемиологического перехода, происходит последовательное вытес нение экзогенных (инфекций, внешних причин) детерминант смертности эндогенными , как правило, связанными с биологическим старением человеческого организма. В наиболее развитых странах мира происходят изменения непосредственно в структуре смертности от заболеваний неинфекционного профиля, что ведет к увеличению доли умирающих с диагнозом злокачественное новообразование (ЗНО). Вместе с тем, прослеживаются устойчивые тенденции в изменении и структуры самой онкологической заболеваемости и смертности .
В контексте наблюдаемых трансформаций в структуре смертности по причинам смерти, по мнению многих экспертов, будут во многом зависеть от медицинских достижений и их внедрения в практику охраны здоровья населения. Однако и модели поведения человека, являются немаловажными факторами риска возникновения онкологических и других неинфекционных заболевания.
Среди комплекса мер, направленных на повышение качества профилактических мер, роли среднего медицинского персонала (фельдшеров ФАП) не уделяется должного значения. Забывается о том, что фельдшер ФАП это жизненно важное звено в профилактической работе в сельской местности.
Объект исследования: профилактическая деятельность фельдшера ФАП .
Предмет исследования: организация работы по профилактике рака шейки матки.
Цель дипломной работы – определить роль фельдшера в профилактике развития рака шейки матки и совершенствование процесса.
Для достижения поставленной цели предлагается решить следующие задачи:
- провести анализ распространенности рака шейки маки среди онкологических заболеваний в России и ПФО;
- провести исследование организации профилактики рака шейки матки;
- провести исследование практической работы по профилактике развития рака шейки матки фельдшера ФАП;
- предложить рекомендации по совершенствованию профилактической работы фельдшера ФАП развития рака шейки матки.
Глава 1. Распространенность онкогинекологических заболеваний
1.1 Частота ЗНО РФ и ПФО
Опухоли (новообразования) представляют собой группу заболеваний, вызванных неконтролируемым делением, ростом числа и распространением опухолевых клеток. Выделяют доброкачественные опухоли, для которых характерен неинвазивный рост и отсутствие метастазов, и злокачественные с инфильтрирующим ростом, разрушающим соседние ткани, и формированием метастазов. Термин «рак» в российской практике употребляют только по отношению к опухолям из эпителия. Опухоли неэпителиального происхождения (как правило, из соединительной ткани) называются саркомами.
В настоящее время преобладает полиэтиологическая теория происхождения новообразований, т.е. одновременная роль нескольких факторов, вызывающих опухолевые трансформации. Тем не менее, медики выделяют отдельные группы причин и факторов риска возникновения онкологических заболеваний:
- генетические (наследственные) фактор;
- поведенческие факторы:
- курение;
- ожирение вследствие потребления и несоблюдения диеты;
- малоподвижный образ жизни;
- чрезмерное потребление алкоголя;
- незащищенное пребывание на солнце;
- инфекции, в частности, передающиеся половым путем;
- несвоевременное и нерегулярное обращение к врачам, в том числе с целью проведения скрининговых процедур.
Очевидно, что виды рака, вызванные поведенческими факторами и факторами окружающей среды, являются потенциально устранимыми. Исследования, проведенные в 2005 году в Японии, показывают, что около 57% смертей мужчин и 30% смертей женщин от рака были вызваны предотвратимыми факторами риска поведенческого характера. При этом наиболее значимыми факторами оказались табакокурение, инфекции и чрезмерное употребление алкоголя. Аналогичное исследование по миру показывает, что 35% смертей от рака в 2001 году были связаны с девятью основными потенциально устранимыми факторами риска.
В мире около 15% всех раков связано с инфекционным происхождением, в развивающихся составляет 25% и более. Существует как минимум десять основных распространенных инфекционных агентов, способных вызвать злокачественное новообразования той или иной локализации (табл. 1).
Таблица 1. Инфекции и ассоциированные с ними формы злокачественных новообразований
Локализация новообразования |
|
Вирус папилломы человека (ВПЧ) | Шейка матки, вульва, анус, пенис, голова и шея |
Вирус гепатита В | Печень |
Вирус гепатита С | Печень |
Helicobacter Pylori | Желудок |
Вирус Эпштейна-Барра | Носоглотка, болезнь Ходжкина, неходжкинская лимфома |
Вирус герпеса человека 8 типа | Саркома Капоши |
Вирус иммунодефицита человека 1 типа (ВИЧ-1) | Саркома Капоши, лимфома |
Т-лимфотропный вирус человека 1 типа | Лейкемия / лимфомы |
Шистосомы | Мочевой пузырь |
Печёночные сосальщики | Желчный проток |
В качестве основных источников статистической информации использовалась Российская база данных по рождаемости и смертности, данные Росстата (форма С51 и данные демографического прогноза), мировая и европейская базы данных ВОЗ по причинам смерти.
Начиная с 2004 года наметилась тенденция к устойчивому росту ожидаемой продолжительности жизни, увеличившись на 5,7 и 3,7 года для мужчин и женщин соответственно за период 2004-2014 годов, достигнув значений 64,6 и 75,9 года. Результаты декомпозиции изменений ожидаемой продолжительности жизни по возрасту и классам причин смерти показывают, что отмеченный рост ОПЖ при рождении у мужчин был обеспечен преимущественно за счет снижения смертности от внешних причин смерти (43,7%) и болезней системы кровообращения (38,7%). Увеличение продолжительности жизни женщин происходило также за счет снижения смертности от БСК (61,6%) и внешних причин (24,1%). Вклад снижения уровня смертности от новообразований в рост ОПЖ - незначителен как для мужчин, так и для женщин, и составляет около 4%.
Класс причин смерти под общим названием «новообразования» очень разнороден, уровень и динамика смертности от отдельных форм рака различается, а поэтому смертность от злокачественных опухолей различных локализаций по-разному влияет на изменение продолжительности жизни мужчин и женщин. Для оценки вклада смертности от основных онкологических причин смерти была выполнена декомпозиция ОПЖ по этим причинам. Результаты расчетов (рис. 1 и 2) показывают, что рост продолжительности жизни мужчин обеспечивался главным образом за счет снижения смертности от ЗНО трахеи, бронхов и легких и рака желудка.
Негативная тенденция отмечался по раку предстательной железы и затрагивала мужчин в возрасте старше 60 лет. У женщин негативный вклад в динамику ОПЖ связан со смертностью женщин от ЗНО женских половых органов и поджелудочной железы. При этом важно отметить, что негативные тенденции в смертности женщин от рака половых органов особенно ярко выражены в возрастной группе 30-45 лет.
Рис. 1. Вклад изменений смертности от отдельных форм рака в общее изменение продолжительности жизни мужчин в разрезе возрастных групп, 2004-2014 годы, лет
Рис. 2. Вклад изменений смертности от отдельных форм рака в общее изменение продолжительности жизни женщин в разрезе возрастных групп, 2004-2014 годы, лет
Показатель активного выявления злокачественных новообразований составил 18,7% (2013 г. – 17,3%). Как низкий следует рассматривать показатель активного выявления новообразований визуальных локализаций. Из числа больных, выявленных активно (95 401) 74,2% имели I-II стадию заболевания (2013 г. 83 916, 69,9%). Опухоли визуальных локализаций I-II стадии заболевания составили 48,0% (2013 г. 45,2%) всех новообразований, выявленных при профилактических осмотрах. Доля больных с опухолевым процессом I-II стадии, выявленных при профилактических осмотрах, среди всех больных с указанной стадией составила в 2014 г. 25,0% (в 2013 г. 22,3%).
Анализ показателей активной диагностики злокачественных новообразований свидетельствует о полном отсутствии в ряде регионов системы профилактических и скрининговых обследований всех категорий населения.
Самый низкий удельный вес злокачественных новообразований, выявленных активно, зафиксирован в следующих территориях (среднероссийский показатель 18,7%): республики Чечня (0,6%), Калмыкия (1,1%), Адыгея (1,2%), Еврейская автономная область (1,3%), республики Тыва (4,3%), Ингушетия (4,5%), Камчатский (4,7%), Ставропольский (5,6%) края, Ярославская область (5,9%).
Максимальные показатели активного выявления отмечены в следующих территориях: Тамбовская область (49,7%), Чукотский автономный округ (47,7%), Курская область (35,3%), Пермский край (32,2%), Республика Хакасия (29,8%), Ленинградская область (29,1%).
Одним из основных показателей, определяющих прогноз онкологического заболевания, является степень распространенности опухолевого процесса на момент диагностики. В 2014 г. 26,7% злокачественных новообразований были диагностированы в I стадии заболевания (2013 г. 25,6%), 25,3% во II стадии (2013 г. 25,2%), 20,6% в III стадии (2013 г. 21,2%). Было выявлено 7 267 случаев рака в стадии in situ, что соответствует 1,3 (2013 г. 1,3) случаев на 100 всех впервые выявленных случаев рака. Рак шейки матки в стадии in situ диагностирован в 4 418 случаях (27,4 случаев на 100 впервые выявленных злокачественных новообразований шейки матки; 2013 г. 27,5); молочной железы 1 218 и 1,9 соответственно (таблица приложения 1).
1.2 Онкогинекологические заболевания в структуре всех ЗНО.
Злокачественные опухоли женских половых органов занимают особое место в клинической онкологии: они являются наиболее часто встречающимися злокачественными новообразованиями у женщин.
Ежегодно в мире регистрируется 12,7 млн. новых случаев рака, из них более 1 млн. приходится на заболевания женской половой сферы . В России в 2014 г. число вновь выявленных заболеваний женских половых органов достигло 47,7 тыс. (17% от числа всех злокачественных опухолей).
Анализ данных о состоянии онкологической помощи больным раком женских половых органов показал, что в 2014 г. в России доля морфологически верифицированных диагнозов при раке яичников (89,1%) была ниже по сравнению с долей рака шейки (97,4%) и тела (96,5%) матки. Распределение больных раком яичников по стадиям достоверно отличается от их распределения при раке шейки и тела матки, характеризуясь вдвое меньшей долей I-II стадий среди больных с впервые в жизни установленным диагнозом и преобладанием III-IV стадий заболевания (табл. 1). Одним из путей снижения смертности от злокачественных новообразований является скрининг - выявление бессимптомного рака путем массовых профилактических осмотров населения. Ранняя диагностика злокачественных опухолей вульвы, вагины и шейки матки возможна с помощью простейших методов обследования - осмотра и пальпации. Раннее распознавание опухолей эндометрия (тела матки) также не требует сложных методов обследования. Менее доступными для ранней диагностики являются лишь опухоли яичников. Несмотря на то, что профилактические осмотры играют значительную роль при диагностике рака шейки матки (выявляется 28,9% заболевших в России), за последние 10 лет доля больных, выявленных при их проведении, увеличилась всего на 5%, значительно ниже доля при раке тела матки (12,2%) и яичников (10,2%). На 100 вновь выявленных больных раком шейки матки приходилось 44 умерших; минимальным этот показатель был в группе больных раком тела матки (31), максимальным - при раке яичников (59).
Показатели состояния онкологической помощи больным раком женских половых органов в России (2000-2010 гг.)
Показатель | Локализация |
||||||||
шейка матки | тело матки | Яичники |
|||||||
2000 | 2005 | 2010 | 2000 | 2005 | 2010 | 2000 | 2005 | 2010 |
|
Морфологическая верификация диагноза, % | 96,0 | 97,5 | 97,4 | 94,7 | 96,5 | 96,5 | 83,1 | 85,7 | 89,1 |
Выявляемостьна профосмотрах, % | 23,9 | 27,4 | 28,9 | 11,2 | 12,2 | 10,2 |
|||
Распределение вновь выявленных больных по стадиям процесса: |
|||||||||
I-II | 58,8 | 59,5 | 59,8 | 74,3 | 77,0 | 78,6 | 32,3 | 34,5 | 35,3 |
28,4 | 29,0 | 29,0 | 14,1 | 13,1 | 12,1 | 37,9 | 38,6 | 40,7 |
|
10,7 | 26,2 | 23,9 | 21,7 |
||||||
не установлена | |||||||||
Летальность на первом году с момента установления диагноза, % | 20,5 | 19,5 | 17,2 | 14,5 | 11,9 | 10,9 | 33,0 | 28,7 | 26,3 |
На 100 вновь выявленных больных приходится умерших | |||||||||
Находились под наблюдением на конец года, тыс. | 169,0 | 156,6 | 159,8 | 138,7 | 164,1 | 196,9 | 64,8 | 75,2 | 89,5 |
Из них 5 лет и более, % | 72,4 | 70,1 | 67,8 | 59,6 | 60,2 | 60,3 | 54,6 | 56,0 | 56,2 |
Индекс накопления контингентов | 14,1 | 12,5 | 11,2 | 10,0 | 10,5 | ||||
Летальность контингентов, % | 12,0 | ||||||||
Летальность на первом году с момента установления диагноза рака тела матки (10,9%) была в 2,3 раза ниже, чем при раке яичников (26,3% соответственно). Сравнение доли больных с опухолями IV стадии и летальности на 1-м году с момента установления диагноза говорит о занижении доли больных с опухолями IV стадии: отношение этих показателей при раке шейки составляло 1,9; при раке тела матки - 1,7; при раке яичников - 1,2. За период с 2000 по 2010 г. отмечено незначительное снижение доли IV стадии.
Сравнительная оценка состояния онкологической помощи в динамике и в различных регионах сопряжена с большими трудностями из-за обилия анализируемых показателей. В связи с этим был разработан кумулятивный критерий, позволивший свести в одно числовое значение множество частных показателей деятельности службы, к которым относятся морфологическая верификация диагноза, выявляемость на профилактических осмотрах, ранняя выявляемость заболеваний, индекс накопления контингентов, их летальность и т.д.
По кумулятивному критерию состояние онкологической помощи больным раком яичников находится на самом низком уровне (0,71) по сравнению с другими локализациями злокачественных новообразований женской половой сферы (0,96-0,98). Это обусловлено низкой верификацией диагноза, большой долей заболеваний IV стадии, высокой одногодичной летальностью, летальностью контингентов и максимальным числом умерших в расчете на 100 заболевших.
В онкогинекологии наиболее подробно изучены и идентифицированы так называемые предраковые состояния и заболевания, поиск которых путем систематических массовых профилактических осмотров стал наглядным примером значения этой формы профилактики и ранней диагностики злокачественных опухолей. В США после внедрения массового скрининга стали чаще выявляться опухоли insitu, чем инвазивные формы. В 2010 г. в России было выявлено 4867 (в 2000 г. - 2343) больных с преинвазивным раком. Основная масса таких больных (2939) имела локализацию в шейке матки: 21 на 100 больных инвазивным раком этой локализации.
Рак шейки матки.
В 2010 г. в России было зарегистрировано 14,7 тыс. больных раком шейки матки (табл. 2). За период с 2005 по 2010 г. прирост абсолютного числа заболевших составил 13,9%. Его доля в структуре заболеваемости злокачественными новообразованиями женского населения России снизилась с 7,0% (в 1989 г.) до 5,3% (в 2010 г.) (5-е ранговое место); в возрастной группе 15-39 лет среди всех злокачественных новообразований у женщин максимальна доля злокачественных новообразований шейки матки (22,4%), в 40-54 г. она составляет 9,4% (2-е место после рака молочной железы) (табл. 3).
Динамика заболеваемости раком женских половых органов в России, 1989-2010 гг.
Показатель | Локализация | Годы наблюдения |
||||||
1989 | 1993 | 1996 | 1999 | 2002 | 2005 | 2010 |
||
Абсолютное число вновь выявленных заболеваний (в тыс.) | Шейка матки | 13,5 | 11,6 | 11,8 | 12,2 | 12,3 | 12,9 | 14,7 |
Тело матки | 11,0 | 11,9 | 13,8 | 14,5 | 15,0 | 17,1 | 19,8 |
|
Яичники | 10,6 | 10,8 | 11,4 | 11,7 | 12,3 | 13,1 |
||
Доля в структуре заболеваемости, % | Шейка матки | |||||||
Тело матки | ||||||||
Яичники | ||||||||
Средний возраст заболевших (лет) | Шейка матки | |||||||
Тело матки | ||||||||
Яичники | ||||||||
Показатель заболеваемости раком: стандартизованный* | Шейка матки | 12,4 | 10,6 | 10,7 | 11,1 | 11,4 | 12,3 | 14,3 |
Тело матки | 10,2 | 11,7 | 12,1 | 12,5 | 13,9 | 15,7 |
||
Яичники | 10,1 | 10,3 | 10,7 | 11,2 |
||||
* Мировой стандарт, десятилетние возрастные группы.
Структура заболеваемости злокачественными новообразованиями женского населения России в разных возрастных группах (2014 г.)*
Ранг | Все возрасты | Возраст, годы |
|||||
0-14 | 40-54 | 55-69 | 70-84 | ||||
Рак молочной железы (20,5%) | Лейкозы (29,9%) | Рак шейки матки (22,4%) | Рак молочной железы (29,6%) | Рак молочной железы (23,0%) | Рак молочной железы (14,6%) | Рак молочной железы (12,6%) |
|
Рак тела матки (7,1%) | Опухоли ЦНС (17,9%) | Рак молочной железы (17,7%) | Рак шейки матки (9,4%) | Рак тела матки (9,7%) | Рак ободочной кишки (9,4%) Рак желудка (8,7%) Рак прямой кишки (5,8%) | Рак ободочной кишки (9,7%) Рак желудка (8,9%) Рак легкого (5,2%) |
|
Рак ободочной кишки (6,9%) | Лимфомы (9,8%) | Лимфомы (9,3%) | Рак тела матки (8,6%) | Рак ободочной кишки (6,8%) |
|||
Рак желудка (6,2%) | Рак почки, мезотелиальныхи мягких тканей (по 7,4%) | Рак щитовидной железы (8,4%) | Рак яичников (7,2%) | Рак желудка (5,4%) Рак прямой кишки, яичников (по 4,9) |
|||
Рак шейки матки (5,3%) | Опухоли костей и суставных хрящей (4,3%) | Рак яичников (7,4%) | Рак щитовидной железы (4,6%) | Рак тела матки (5,0%) | Рак поджелудочной железы, прямой кишки (по 4,7%) |
||
* Исключены немеланомные новообразования кожи.
Ежегодно в мире регистрируется 529,4 тыс. больных раком шейки матки (9% среди всех злокачественных новообразований у женщин) и 274,9 тыс. умерших. Широкое распространение рака шейки матки отмечено в развивающихся странах, на которые приходится 78% случаев, а его доля достигает 15% от числа всех злокачественных новообразований у женщин (в развитых странах - 4,4%). Настораживает прирост заболеваемости раком шейки матки в России (с 12,4 на 100 тыс. женского населения в 1989 г. до 14,3 на 100 тыс. в 2010 г. - 15,3%) в то время как в странах Запада, где проводится массовый скрининг, позволяющий диагностировать предраковые состояния и ранние формы рака, показатели заболеваемости (и смертности) значительно снизились за последнее десятилетие. Средний возраст заболевших в России снизился на 6 лет: с 58 (в 1989 г.) до 52 лет (в 2010 г.). Максимальные возрастные показатели заболеваемости раком шейки матки зарегистрированы в возрастной группе 50-64 года (31-32 на 100000), тела матки - в возрастной группе 60-64 года (91,9 на 100000), яичников - в возрастных группах 60-74 и 70-74 года (40-41 на 100000) (рис. 1). Анализ динамики возрастных показателей заболеваемости в России с 1990 по 2010 г. выявил некоторую тенденцию к снижению частоты случаев рака шейки матки в возрастных группах 60-69 лет и 70 лет и старше и к росту числа заболеваний раком тела матки и яичников во всех возрастах (табл. 3).

Рисунок 3. Возрастные показатели заболеваемости раком женских половых органов в России в 2014 г. (на 100 тыс. женского населения)
Более 6,2 тыс. больных ежегодно умирает от рака шейки матки в России (4,6% среди всех злокачественных новообразований у женщин) (табл. 4). Средний возраст умерших составляет 58 лет (в 1991 г. - 64 года). Смертность от рака шейки матки в среднем по России в 2014 г. (5,2 на 100000) была в 2,8 раза ниже, чем заболеваемость (14,3 на 100000). У женщин в возрасте от 15 до 40 лет рак шейки матки является основной причиной смерти среди всех больных злокачественными новообразованиями, достигая 19,5%; в 40-54 года рак шейки матки переходит на 2-е место (9,7%).
Среди 50 стран мира самые высокие показатели смертности от рака шейки матки зарегистрированы в Зимбабве (43,1 на 100000), Мали (25,4 на 100000) и Колумбии (18,2 на 100000); минимальные (менее 3 на 100000) - в Австралии, США, Канаде, Финляндии, Греции, Италии. В развивающихся странах мира стандартизованные показатели смертности были в 3 раза выше, чем в развитых странах (9,8 и 3,2 на 100000).
Показатели выживаемости варьируют: хорошие прогнозы отмечены в странах с низким риском рака шейки матки (в США - 72% , в европейских странах - 60%). Даже в развивающихся странах, в которых чаще диагностируются более распространенные (запущенные) случаи рака шейки матки, выживаемость достигает 48%; самые низкие показатели - в Восточной Европе. Показатели выживаемости в зависимости от степени распространенности процесса представлены в табл. 5.
Показатели 5-летней относительной выживаемости больных злокачественными новообразованиями, выявленными в США в 1999-2005 гг. (%)*
Локализация | Процесс |
|||
Всего | в том числе: |
|||
Шейка матки | ||||
Тело матки | ||||
Яичники | ||||
* Степень распространенности процесса:
- локализованный;
- переход на окружающие ткани, регионарные метастазы;
- отдаленные метастазы.
Рак тела матки.
Географическое распределение рака тела матки аналогично распространению рака яичников. Для него характерно большее ежегодное число новых случаев (188,8 тыс. в мире), чем смертей, что может объясняться наиболее благоприятным прогнозом. В России ежегодно регистрируется более 19,8 тыс. больных раком тела матки. За период с 2005 по 2010 г. прирост абсолютного числа заболевших составил 15,6%. Средний возраст заболевших раком тела матки в России составлял в 2010 г. 62 года (умерших - 68 лет). Соотношение рака эндометрия и рака шейки матки в европейских странах и США составляет от 1:2 до 1:7.
В развитых странах мира заболеваемость раком тела матки (12,9 на 100000 женского населения) была в 2,2 раза выше, чем в развивающихся (5,9 на 100000). В странах СНГ заболеваемость раком тела матки колебалась от 4,5-9,9 на 100000 (в Азербайджане, Кыргызстане, Казахстане и Армении) до 15,7-20,2 на 100000 (в России, Беларуси и на Украине). За период с 1989 по 2010 г. стандартизованные показатели заболеваемости в России увеличились с 9,6 до 15,7 на 100000 (прирост составил 63,5%).
В структуре заболевших доля рака тела матки достигала 7,1%. В России он занимал 3-е ранговое место после молочной железы и шейки матки в возрастной группе 40-54 года (8,6%) и 2-е место в возрастной группе 55-69 лет (9,7%); с увеличением возраста он переходит на 5-е место в 70-84 года и его доля сокращается до 5%.
Показатели заболеваемости раком тела матки в 2010 г. увеличились во всех возрастных группах, начиная с 25 лет. Они были максимальные в возрастной группе 60-64 года (91,9 на 100000). Интенсивность роста заболеваемости с возрастом хорошо характеризует индекс накопления возрастного пика заболеваемости к уровню заболеваемости в возрасте до 50 лет, например, в 45-49 лет. При злокачественных новообразованиях женских половых органов он колебался от 1,0 при раке шейки матки до 3,7 при раке тела матки и 1,7 - при злокачественных новообразованиях яичников.
Среди 50 стран мира самые высокие показатели смертности от рака тела матки (5-7 на 100000) в Чехии, Словакии, Кыргызстане, Кубе и Азербайджане, низкие - в Китае, Японии, Мали, Уганде (0,4-1,2 на 100000).
Злокачественные новообразования яичников.
Ежегодно в мире регистрируется 225,5 тыс. новых случаев злокачественных новообразований яичников и 140,2 тыс. смертей от него, в США - 22,3 тыс. и 15,5 тыс., в России - 13,1 тыс. и 7,8 тыс. За период с 2005 по 2010 г. прирост абсолютного числа заболевших составил 6%. Во многих странах эта патология занимает среди злокачественных новообразований 5-е ранговое место. Злокачественные опухоли яичников встречаются у женщин всех возрастных групп, начиная с младенчества. В России доля рака яичников среди злокачественных новообразований колебалась от 4,9% (в 55-69 лет) до 7,2% (в 40-54 года) и 7,4% (в 15-39 лет). Показатель заболеваемости достигал наибольшего значения (41,2 на 100000) в возрастной группе 60-64 года. В Англии, Дании, Финляндии, Чехии, Швеции заболеваемость этой формой рака составляла 9-15 (на 100 тыс. женского населения, мировой стандарт). В развитых странах мира заболеваемость раком яичников была в 1,9 раза выше, чем в развивающихся (9,4 и 5,0 на 100000).Стандартизованные показатели заболеваемости злокачественными новообразованиями яичников в России увеличились на 20,4% (с 9,3 на 100000 в 1989 г. до 11,2 на 100000 в 2010 г.).
В 2010 г. в России от рака яичников умерло 7,8 тыс. больных (5,8% среди всех злокачественных новообразований у женщин). В структуре умерших от злокачественных новообразований рак яичников стоит на 5-м месте. Максимальна доля умерших в возрастной группе 40-54 года (9,2%, 3-е ранговое место); с увеличением возраста она сокращается до 6,8% в возрастной группе 55-69 лет и 4,5% в возрастной группе 70-84 года. Доля умерших от рака яичников составляла 35% среди всех злокачественных новообразований женских половых органов. Средний возраст заболевших в России составлял 59 лет (умерших - 64 года).
1.3 Пути совершенствования ранней диагностики ЗНО
Профилактика в онкологии - система мероприятий, направленных на предупреждение возникновения злокачественных опухолей и их прогрессирования.
Один из ведущих отечественных ученых-онкологов, академик РАМН Н.П. Напалков (1932–2008) несколько лет назад писал: «Нет сомнения в том, что последовательное и широкое внедрение мер по первичной профилактике рака дело, хотя и очень нелегкое, но способное в течение одного-двух десятилетий вполне реально сократить смертность населения страны от злокачественных опухолей, по крайней мере, на одну треть». (По оценкам ВОЗ только соблюдение населением здорового образа жизни может предотвратить 40% случаев заболевания раком, еще 20% может быть предотвращено предупреждением хронических инфекций, ведущих к возникновению опухолей). Опыт экономически развитых стран подтверждает такую возможность.
Вместе с тем, ни в России, ни за рубежом первичной профилактике рака не уделяется должного внимания (правда, в экономически развитых странах этот феномен проявляется в значительно меньшей степени) .
Разнообразные виды излучений, огромное количество канцерогенов, содержащихся и в воздухе, и в питьевой воде, и в продуктах питания постоянно оказывают свое разрушающее, а именно канцерогенное действие. Канцерогенные вещества очень разнообразны от простых (как четыреххлористый углерод - ССl 4 ) до сложных полициклических гетероциклических соединений (метилхолантрен или бензантрацен). Их эффект основан на стимуляции размножения клеток-предшественниц. Исходя из известных нам сведений о канцерогенных факторах разрабатываются и осуществляются соответствующие мероприятия по ликвидации провокаторов злокачественного роста как во внешней, так и во внутренней среде. Основные принципы профилактики заложены в здоровом образе жизни каждого человека.
Предупреждение канцерогенного воздействия внешних и внутренних факторов, нормализация питания и образа жизни, повышение устойчивости организма к вредным факторам включается в понятие первичной профилактики рака. Под этим понятием подразумеваются, с одной стороны, широкие оздоровительные мероприятия государственного масштаба. Основные источники загрязнения атмосферного воздуха, почвы, водных бассейнов - предприятия металлургической, коксохимической, нефтеперерабатывающей, химической, целлюлозно-бумажной промышленности, а также транспорт.
Под влиянием облучения злокачественные опухоли могут возникать во всех органах, но наиболее высок риск развития гемобластозов, поражений кожи, костей, легкого, молочной и щитовидной желез, слюнных желез, яичников. Использование средств индивидуальной защиты на вредных производствах существенно снижает заболеваемость злокачественными опухолями.
Первичная профилактика рака предполагает закрытие вредных производств. Планирование и строительство современных производств должны находиться под контролем, предусматривать переработку токсичных продуктов в безвредные, утилизацию отходов, строительство очистных сооружений, предохраняющих от заражения вредными продуктами окружающей среды. Оздоровление экологии нашей страны требует рациональной планировки городов, жилых и общественных зданий. Хорошая аэрация в них избавляет человека от контакта с канцерогенами. Профилактика опухолей должна предусматривать меры законодательного контроля за предельно допустимыми концентрациями вредных воздействий (химических, механических, радиоактивных, СВЧ и др.). Предупреждать их вредное воздействие на человека, контактирующего с ними на производстве и в быту. Должно быть предусмотрено проведение соответствующих мероприятий по рациональной защите работников вредных производств. Например, древесная пыль и использование лакокрасочной продукции приводит к развитию рака слизистых носовых пазух у рабочих деревообрабатывающей промышленности. Профессиональные факторы вызывают чаще опухоли тех локализаций, для которых характерен прямой контакт с канцерогенными факторами. Все мероприятия, исключающие воздействие перечисленных факторов на человека, являются прерогативой государства.
С другой стороны, каждый человек должен знать, что, соблюдая элементарные нормы здорового образа жизни, он предупреждает развитие у себя злокачественных новообразований. Для органов полости рта и глотки, а также слизистой оболочки верхних отделов дыхательной и пищеварительной системы установлено, что табак и алкоголь являются ведущими факторами риска в развитии рака. Соответствующая разъяснительная работа должна проводиться повсеместно. Информация для населения должна содержать основные сведения о личной профилактике злокачественных опухолей разной локализации, о симптомах, которыми проявляется опухоль в начальных стадиях заболевания, о вариантах самообследования для своевременного распознавания наиболее распространенных опухолей и др. Эти сведения помещаются на стендах «немой информации» в поликлиниках, публикуются в научно-познавательных журналах и брошюрах, распространяются в виде листовок. Необходимые сведения могут быть изложены также в виде лекций по местному радио или для организованного населения.
Почти для каждой локализации рака известны предопухолевые состояния. В связи с этим в отношении значительного количества предраков, а следовательно, и злокачественных опухолей известны соответствующие предупредительные меры. Так, основой профилактики рака легкого является борьба за чистоту вдыхаемого воздуха и активацию процессов самоочищения легкого. Необходима пропаганда отказа от курения, рекомендация занятий спортом, систематических физических нагрузок на свежем воздухе. Для профилактики рака органов желудочно-кишечного тракта необходимо соблюдение правил гигиены питания и полости рта. Для профилактики рака молочной железы необходим отказ от абортов и бесконтрольного применения гормональных контрацептивов. Очень важно длительное, нормальное вскармливание детей грудью. Необходимо освоение методик самообследования по наиболее частым онкологическим заболеваниям. Иммунизация для предупреждения инфекции онкогенными типами вируса папилломы человека также является стратегией первичной профилактики рака шейки матки.
Важную роль в предупреждении и лечении рака играют витамины. Недостаток жирорастворимых витаминов часто сопровождает развитие предопухолевой патологии. В ряде случаев проведение интенсивной витаминотерапии является основным компонентом лечения предраковых заболеваний. Особенно часто с этой целью используются препараты жирорастворимых витаминов, играющих огромную роль в дифференцировке эпителиальных клеток.
В конце 80-х гг. прошлого века было выявлено, что именно комбинация витаминов А, С и Е является важнейшим для здоровья человека оксидантом. Некоторое количество свободных радикалов образуется в процессе окисления, когда в клетках происходит реакция высвобождения энергии с участием кислорода. Небольшое количество свободных радикалов необходимо для борьбы с бактериями и вирусами, однако большие количества свободных радикалов в организме в высшей степени вредны. Свободные радикалы образуются в значительной степени под воздействием загрязняющих веществ, таких, как табачный дым, ультрафиолетовое солнечное излучение. Витамины А, С, Е способны нейтрализовать эти частицы прежде чем они смогут повредить клеткам организма. Антиоксиданты связывают свободные радикалы. Значительная часть опухолей возникает вне заметной связи с каким-нибудь канцерогенным воздействием .
Кроме того, есть еще ряд микроэлементов, которые помогают бороться со свободными радикалами. Первая линия обороны в борьбе с повреждениями, вызванными свободными радикалами, проходит через группу ферментов, которые содержат ионы металлов: Mg (марганца), Cu (меди), Zn (цинка), Se (селена) - металлопротеиназы. Их образование происходит при участии указанных витаминов. Если витаминная недостаточность является следствием нарушенной всасывательной и переваривающей функции желудочно-кишечного тракта, то включение витаминных препаратов в комплексное лечение совершенно необходимо.
Соблюдение правил личной гигиены и своевременное лечение хронических гинекологических заболеваний служат профилактикой рака шейки матки. Многочисленные роды с разрывом шейки матки, беспорядочная и ранняя половая жизнь также способствуют развитию злокачественных опухолей женских половых органов.
Нормализация веса тела один из важных факторов профилактики большинства злокачественных опухолей, так как ожирение и гиподинамия активно способствуют развитию рака, снижая иммунитет и активизируя повреждения ДНК. Почти половина всех случаев рака матки и пищевода у женщин связано с ожирением и избыточным весом. С избыточным весом связано развитие рака почки, простаты, поджелудочной железы, рака яичника, лейкоза, неходжинской лимфомы, рака молочной железы и мочевого пузыря. Риск рака молочной железы и мочевого пузыря возрастает только у женщин в менопаузе. Рекомендуется ограничение жареной, копченой, нитрит-содержащей пищи как источников канцерогенов.
Индивидуальная профилактика рака каждого человека состоит в знании и соблюдении практических рекомендаций с целью снижения онкологического риска. Осведомленность о признаках или симптомах, которые могут относиться к раку, имеет важное значение. Признаки и симптомы, которые не являются абсолютно специфическими для рака, не должны игнорироваться, а должны служить предупреждением человеку о необходимости проконсультироваться и получить совет у врача.
Таковы индивидуальные меры профилактики при наиболее частых раковых опухолях человека, т.е. отказ от вредных привычек и рациональное питание уменьшают, а в ряде случаев устраняют риск возникновения опухолей. Из перечисленных выше мер профилактики злокачественных опухолей следует, что в основе такой первичной профилактики лежит соблюдение правил личной гигиены, уменьшение контакта с канцерогенами, содействие нормальной функции органов и систем человеческого организма, повышение иммунной защиты. Рак - длительный многостадийный процесс. Известно, что до достижения опухолью легкого, желудка или молочной железы размера 1-1,5 см в диаметре проходит 5-10 лет. Большинство опухолей закладывается в 25-40 лет, а иногда и в детстве, поэтому профилактику рака следует начинать как можно раньше .
К вторичной профилактике рака относится ряд мер при наличии уже развившихся избыточных клеточных разрастаний с атипией эпителия и сформировавшихся предраковых состояний. Из больных, страдающих предопухолевыми заболеваниями, формируются группы повышенного риска, что является перспективным направлением многоплановой медицинской профилактики рака. Для этого разработаны многоцелевые скрининговые программы. В плане мероприятий вторичной профилактики осуществляется наблюдение за группами риска, выявление и лечение предраковых заболеваний и ранняя диагностика рака.
Под скринингом понимают применение различных методов исследования, позволяющих диагностировать опухоль на ранней стадии, когда еще нет симптомов болезни. Целью скрининга является раннее активное выявление бессимптомного рака и его лечение. Необходимо отличать скрининг от ранней диагностики. Ранняя диагностика - выявление заболевания у лиц, которые при появлении у них симптомов заболевания сами обратились за медицинской помощью. Скрининговые программы рака должны проводиться с учетом их целесообразности для тех форм рака, которые являются важной проблемой здравоохранения страны или региона ввиду высокой заболеваемости и смертности от них.
В России считается целесообразным проведение скрининга рака шейки матки, так как заболеваемость и смертность от этого вида рака остается высокой. Для обнаружения рака шейки матки применяют цитологическое исследование мазка с поверхности шейки. В настоящее время популяционный цитологический скрининг представляет собой идеальную модель вторичной профилактики рака шейки матки: цитологическое исследование мазков с шейки матки выполняются у всех обратившихся в поликлинику впервые в текущем году. Вследствие этого мероприятия значительно увеличилось выявление ранних форм этого заболевания.
Об эффективности того или иного метода скрининга можно судить на основании снижения частоты выявления распространенных форм опухолей данного вида и увеличение частоты ранних форм. Наиболее достоверен показатель снижения смертности и улучшение выживаемости от рака в регионе, в котором проводился скрининг, по сравнению с регионами, в которых скрининг не проводился. В настоящее время критерии выделения тех или других категорий населения в группы повышенного риска по тому или иному онкологическому заболеванию еще при многих заболеваниях окончательно не определены. В то же время клиническая практика показывает, что правильное лечение состояний, определенных как предопухолевые, спасает человека от потенциальной возможности заболеть раком. В этих группах осуществляется диспансерное наблюдение до момента установления факта излечения предракового заболевания. Это значительно повышает качество профилактических осмотров, позволяет эффективно использовать инструментальные методы обследования (рентгеноскопию, рентгенографию, эндоскопию с биопсией и т.д.), осуществлять направленный поиск патологического процесса и обеспечивает преемственность в диагностике и лечении больных. При проведении массовых профилактических осмотров учитываются возможности диагностических методов, их простота и экономические затраты.
Третий этап профилактики рака заключается в предупреждении прогрессирования уже возникшей злокачественной опухоли (генерализации, рецидива) путем своевременного применения рациональных методов лечения, а также квалифицированного осмотра и специального обследования лиц, получивших полный курс первичного лечения и наблюдающихся без явных признаков рецидива и мета- стазов, находящихся на диспансерном наблюдении. Сюда же относится и предупреждение новых случаев опухолевых заболеваний у излеченных онкологических больных. Обычно эти мероприятия осуществляются в специализированных клинических или поликлинических подразделениях.
Таким образом, в систему профилактики рака входят мероприятия по борьбе с вредными привычками, по выявлению и лечению больных с предопухолевыми заболеваниями; т.е. выявление и обследование групп «повышенного риска», охрана внешней среды, рациональная противораковая пропаганда. Для сокращения смертности от опухолевых заболеваний существует два подхода: уменьшение числа новых случаев за счет первичной профилактики и увеличения процента излечения и выживаемости тех, у кого уже возник рак, за счет ранней диагностики и рациональной терапии. «Однако лучше осуществлять профилактику болезни, чем ее лечение» (Давыдов М.И., 2007). Более целесообразной, чем массовые осмотры в настоящее время принято считать разработку анкет, которые заполняют обследуемые пациенты, чтобы при выявлении настораживающих симптомов, свойственных какому-либо заболеванию, провести более детальное обследование. Изучаются те или иные особенности образа жизни населения, которые могли бы повлиять на развитие наиболее частых в данном регионе опухолей и в случае выявления таких факторов основной упор делается на пропаганду соответствующих знаний среди населения.
Таким образом, можно сделать выводы.
Выявлено, что первичная профилактика направлена на выявление и устранение или ослабление влияния неблагоприятных факторов окружающей среды на процесс возникновения злокачественной опухоли. Прежде всего, это полное устранение или минимизация контакта с канцерогенами.
Установлено, что вторичная профилактика направлена на выявление и устранение предраковых заболеваний и выявление злокачественных опухолей на ранних стадиях процесса. К исследованиям, позволяющим эффективно выявлять предопухолевые заболевания и опухоли, относятся: маммография, флюорография, цитологическое исследование мазков с шейки матки и цервикального канала, эндоскопические исследования, профилактические осмотры, определение в биологических жидкостях уровня онкомаркеров и др.
Определено, что третичная профилактика з аключается в предупреждении рецидивов и метастазов у онкологических больных, а также новых случаев злокачественных опухолей у излеченных пациентов. Для лечения злокачественной опухоли и третичной профилактики рака следует обращаться только в специализированные онкологические учреждения.
Глава 2. Анализ частоты онкогинекологической патологии в Ульяновской области.
2.1 Частота ЗНО в Ульяновской области.
Злокачественные новообразования в Ульяновской области занимают второе место по частоте и социальной значимости среди причин смертности населения после сердечно-сосудистых заболеваний и составляют до 15% всех причин.
Рис. 3. Структура заболеваемости злокачественными новообразованиями населения Ульяновской области в 2011 году (оба пола)
За 9 месяцев 2012г. в Ульяновской области:
- выявлено 3902 новых случаев злокачественных новообразований (на 3% по сравнению с 2011г.);
- умерло от злокачественных новообразований 1856 человек (на 5% по сравнению с 2011г.);
- запущенность – 24,8%;
- морфологическая верификация - 30,6%;
- 67,6% первичных онкобольных направлены из первичных онкологических кабинетов (ПОК).
На основании данных можно построить таблицу 2.
Таблица 2. Работа первичных онкологических кабинетов Ульяновской области
В 2013 году в Ульяновской области:
- выявлено 5 319 онкозаболеваний, в т.ч. у 35 детей;
- умерло от злокачественных новообразований 2 825 человек, в т.ч. 9 детей.
На конец 2013 года контингент больных со злокачественными новообразованиями составил 28083 человека – это 2,2% населения области. Из них 51,8% больных состоят на учёте 5 лет и более. Этот показатель увеличился по сравнению с 2012 годом (2012 – 50,2%, РФ 2012 – 51,1%). Онкологическая заболеваемость и смертность в Ульяновской области значительно превышает среднероссийские значения. В ПФО Ульяновская область по итогам 2013г. занимает 3-е место по величине показателя смертности от злокачественных новообразований после Оренбургской и Нижегородской области. Структура причин общей смертности по Ульяновской области за 2013 г. представлена на рис. 4
Рис. 4. Структура причин общей смертности, Ульяновская обл., 2013 г.
Злокачественные новообразования занимают второе место по частоте среди причин смертности населения после сердечно-сосудистых заболеваний и составляют 16% всех причин.
Выше, чем в среднем по области заболеваемость злокачественными новообразованиями в г. Новоульяновске, Бакзарносызганском, Барышском, Вешкаймском, Инзенском, Кузоватовском, Майнском, Старокулаткинском, Тереньгульском районах, г. Ульяновске.
Ниже, чем с среднем по области заболеваемость в следующих муниципальных образованиях: Карсунский, Мелекесский, Николаевский, Павловский, Новомалыклинский, Новоспасский, Радищевский, Сенгилеевский, Старомайнский, Сурский, Ульяновский, Цильнинский, Чердаклинский р-ны, г Димитровград.
Выше, чем в среднем по области смертность от ЗНО в следующих МО –Старокулаткинский, Инзенский, Карсунский районы, г.Н.Ульяновск, Майнский, Сурский, Барышский, Новомалыклинский, Радищевский, Сенгилеевский, Кузоватовский районы, г. Димитровград. Ниже, чем в среднем по области – Мелекесский, Павловский, Тереньгульский районы, г. Ульяновск, Баз. Сызганский, Чердаклинский, Цильнинский, Новоспасский, Вешкаймский, Ульяновский, Старомайнский, Николаевский районы.
Первые места в структуре заболеваемости злокачественными новообразованиями мужского населения Ульяновской области распределены следующим образом: опухоли трахеи, бронхов, легких (21,3%), кожи (10,2%), предстательной железы (9,5%), желудка (8,2%). В 2013 году рак простаты переместился с 4-го места на 3-е.
Злокачественные опухоли молочной железы (21,7%) являются ведущей онкологической патологией женского населения Ульяновской области, далее следуют новообразования кожи (14,4%), тела матки (7,9%), ободочной кишки (7,0%), желудка (5,7%).
Показатель запущенности в 2013 г. остался без динамики по сравнению с предыдущим годом – 25,2%. Показатель выше среднероссийского и по ПФО.
Высокий уровень запущенности в следующих районах: Кузоватовский, Базарносызганский, Старомайнский, Карсунский, Барышский, Тереньгульский, Майнский, Вешкаймский, Чердаклинский, Николаевский, Цильнинский, Новомалыклинский.
По г. Ульяновску запущенность ЗНО составила 24,8%. Высокий уровень запущенности в ЦК МСЧ, поликлинике №1, ЦГКБ, поликлинике №2, отделенческой больнице ОАО РЖД (прикрепленное население).
Одногодичная летальность по сравнению с прошлым годом снизилась на 2,0% до 30,8% (2012г УО -31.4%, РФ 26.7%) .
Среди муниципальных образований менее 80% охвата профилактическими осмотрами зарегистрировано в Радищевском, Тереньгульском, Старомайнском, Ульяновском, Барышском, Новоспасском, Кузоватовском районах, Рязановской и в Никольской (самый низкий) участковых больницах. По г. Ульяновску самый низкий охват в городских больницах № 3 и 4, ЦК МСЧ, отделенческой больнице ОАО РЖД (прикрепленное население).
Высокая выявляемость рака в Рязановской, Мулловской участковых больницах, Сурском, Новомалыклинском, Новоспасском, Тереньгульском районах, отделенческой больнице ОАО РЖД, городской больнице №3, поликлинике №2.
Таким образом, анализ статистических данных динамики злокачественных новообразований показал, рост данной категории заболеваний не только в Ульяновской области, но и целом по России. Кроме того, данные свидетельствует о низкой профилактической работе и выявляемости рака на ранних стадиях во многих районах Ульяновской области и больницах г. Ульяновска.
2.3 Проблемы ранней диагностики онкогинекологии.
В современной профилактической медицине выдвинута концепция двух-этапной системы обследования. На I этапе проводится первичное выявление, скрининг («отсев» больных от здоровых). Лица, прошедшие через сито диагностической программы, считаются здоровыми. На II этапе методы углубленной диагностики применяются только при подозрении на предрак или рак органов репродуктивной системы. Уменьшение показателей заболеваемости и смертности от РШМ отмечено в регионах, где цитологическим скринингом охвачено большинство женщин. В целом по стране выявляется лишь снижение этих показателей для РШМ, тогда как заболеваемость и смертность от РЭ, РМЖ и РЯ увеличиваются. Не вызывает сомнений, что профилактический осмотр должен быть заменен профилактическим обследованием, так как параллельно с осмотром необходимо применять высоко-достоверные и «чувствительные» специальные методики. Целью такого обследования является выявление не только начальных стадий рака, но также фоновых процессов, предраковых заболеваний и преинвазивного рака. Исключительная роль в ранней диагностике предрака и рака органов репродуктивной системы принадлежит врачу женской консультации. Многие женщины еще избегают прохождения массовых обследований, что главным образом связано с недостаточной осведомленностью об онкологических заболеваниях, возможностях их ранней диагностики и излечения. Между тем почти каждая женщина неоднократно посещает врача женской консультации по различным поводам (сохранение или прерывание беременности, контрацепция, гинекологические заболевания и т.д.). Это удобный повод для цитологического исследования шеечно-влагалищных мазков у всех женщин и выявления с помощью анкетирования факторов риска РЭ, РЯ и РМЖ. Имеются существенные различия между методами раннего выявления и углубленной диагностики гинекологического рака. Для того чтобы диагностическая методика была принята как инструмент скринирующей программы, должны быть соблюдены несколько критериев. Нужно, чтобы методика легко выполнялась в поликлинических условиях, безболезненно переносилась женщиной и не давала осложнений. Оборудование и реактивы не должны быть дорогими. Как только получен материал для исследования, его оценка должна быть выполнена быстро и с минимальным количеством ошибок. Здесь уместно заметить, что методики выявления первичного рака органов репродуктивной системы не должны давать ложноотрицательных заключений, так как гиподиагностика может привести к потере времени и прогрессированию заболевания. Менее опасны ложноположительные или предположительные заключения (подозрение на рак), так как гипердиагностика может быть исправлена на II этапе углубленного обследования, которое при необходимости проводится в условиях стационара.
Результаты обследования женщин, имеющих факторы риска PЭ Рассмотрим результаты скрининга 2204 женщин из групп риска. В любом учебнике по гинекологии можно прочесть, что маточные кровотечения отмечаются у 98-99% больных раком эндометрия. Так ли это? Наиболее существенный результат проведенного исследования заключается в том, что среди женщин из групп риска, не имевших гинекологических жалоб и симптомов, было активно выявлено 124 больных атипической гиперплазией (5,6%) и 69 - раком эндометрия (3,1%). При обследовании больных с синдромом Штейна-Левенталя часто определяются железистая гиперплазия и нередко - атипическая гиперплазия. Риск развития рака увеличивается у больных с синдромом склерокистозных яичников в сочетании с ожирением и при длительном клиническом течении. Предрасположенность к атипической гиперплазии и раку эндометрия наблюдается у больных с миомой матки в пре- и постмепопаузе в сочетании с ожирением, сахарным диабетом и эстрогенным типом кольпоцитологической реакции. Нелеченая железистая гиперплазия эндометрия в течение 3 лет и более может регрессировать (40%), оставаться стабильной (55%), прогрессировать в атипическую гиперплазию (2,6%) или рак (1,7%). Это определяет необходимость лечения рецидивирующих гиперпластических процессов и динамического контроля за состоянием эндометрия. Продолжение менструальной функции после 50 лет повышает риск возникновения железистой и атипической гиперплазии эндометрия. Высокая частота обнаружения бессимптомных гиперпластических процессов и рака эндометрия при величине кариопикнотического индекса, превышающей 40-50%, свидетельствует о целесообразности обследования состояния эндометрия в этой группе женщин. При сочетании сахарного диабета и ожирения определяются выраженные нарушения менструальной и генеративной функций. Риск атипической гиперплазии и рака оказывается наиболее высоким при начале развития ожирения диэнцефального типа в пубертатном возрасте, рождении крупных детей (масса более 4000 г), выявлении инсулинонезависимого сахарного диабета в пре- и постменопаузе. Таким образом, патогенетический подход к оценке факторов и формированию групп открывает новые возможности раннего распознавания гиперпластических процессов и рака эндометрия. Эффективность предпринятого обследования женщин, страдающих эндокринно-обменными нарушениями, могла бы существенно возрасти, если одновременно предпринять у них маммографию (для выявления ранних форм РМЖ) и ультразвуковое исследование таза (для диагностики увеличения яичников). Если обратиться к специальной литературе, то нетрудно заметить, что каждый автор стремится к детализации методов ранней диагностики какой-либо одной локализации рака. Иными словами, наблюдается тенденция изолированного изучения диагностики и профилактики четырех основных локализаций рака органов репродуктивной системы - РШМ, РЭ, РЯ и РМЖ. Очевидно, что ранняя диагностика и профилактика указанных четырех опухолей должна проводиться по единой программе. Обязательное применение цитологического обследования у всех женщин старше 20 лет позволяет решить вопросы ранней диагностики дисплазии, про- и инвазивного РШМ. Возможности дальнейшего усовершенствования профилактических обследований связаны с активным выявлением РЭ, РЯ и РМЖ в группах риска. Учитывая сходную направленность эндокринно-обменных нарушений, играющих определенную роль в патогенезе РЭ, РМЖ и РЯ, представляется перспективным формирование общей группы риска для активного выявления указанных трех опухолей. Факторы риска у каждой женщины могут быть представлены со значительной вариабельностью. Основной принцип формирования общей группы риска- наличие 3 и более факторов риска у женщин старше 40 лет и сочетание признаков гиперэстрогепии с нарушениями жирового и/или углеводного обмена. Далее должен быть осуществлен активный поиск онкологической патологии в трех тканях-мишенях - эндометрии, молочных железах и яичниках. С этой целью применяется цитологическое исследование эндометриальных аспиратов, маммография, ультразвуковое исследование таза.
Важным профилактическим мероприятием по раннему выявлению патологии шейки матки является исследование мазка на онкоцитологию. Как правило, у здоровых женщин в любом возрасте этот анализ необходимо выполнять минимум 1 раз в год. При наличии изменений на шейке матки цитологическое исследование нужно проводить чаще. При
прегравидарной подготовке
мазок на онкоцитологию обязателен.
За 24 часа до взятия мазка нельзя спринцеваться, заниматься сексом и вводить вагинальные свечи, крема и гели. Мазок должен быть взят не ранее 5 дней от первого дня менструального цикла и не позднее, чем за 5 дней до месячных. Оптимальный срок – за 2 недели до ожидаемой менструации. Если во влагалище есть воспалительный процесс, то информативность исследования резко снижается.
При осмотре с помощью гинекологических зеркал врач тампоном вначале убирает слизистые выделения из шейки матки. Затем специальной цитощеткой забирает клетки цервикального канала и наружной поверхности шейки с последующим нанесением материала на предметное стекло. Для этого он слегка прижимает щеточку к слизистой оболочке и покручивает ее. Никаких болевых или неприятных ощущений при этом нет. В некоторых случаях при выраженном воспалении возможны незначительные сукровичные выделения в течение нескольких минут после взятия мазка.
В лаборатории мазок под микроскопом смотрят специально обученные врачи-цитологи. Затем результат доставляется к врачу. Возможны следующие варианты:
- цитограмма без особенностей, что позволяет считать женщину здоровой;
- цитограмма воспаления, что требует дополнительного обследования и лечения с последующим повторением исследования;
- различные степени дисплазии шейки матки, при которых необходимое дальнейшее обследование и лечение в кабинете патологии шейки матки;
- рак шейки матки, с которым женщина направляется на лечение в онкодиспансер.
Регулярное цитологическое обследование позволяет своевременно выявить предраковые изменения, что особенно важно при наличии эрозии шейки матки, инфицировании вирусом папилломы человека и при планировании беременности. Алгоритм «Взятие мазка на цитологическое исследование» представлен в приложении 2.
Приложение 1
Сведения о контингенте больных со злокачественными новообразованиями,
состоящем на учете в онкологических учреждениях в 2014 г. шейка матки (с53)
Техника выполнения манипуляции
Показания
Обследование на онкопатологию женщин от 18 лет и старше
Противопоказания
Нет
Место проведения манипуляции
Смотровой (манипуляционный) кабинет
Состав бригады
Акушерка смотрового кабинета
Санитарка
Спецодежда
1. Чистый рабочий халат
2. Одноразовые: маска, колпак
3. Одноразовый фартук
Оснащение
1. Кресло гинекологическое
2. Светильник смотровой
3. Манипуляционный столик
4. Зеркало Куско
5. Пинцет
6. Стерильные ширики
7. Одноразовая цервикс-щетка
8. Предметное стекло
9. Контейнеры (емкости) для дезинфекции ИМН и сбора медицинских отходов
Обработка рук
Гигиеническое мытье
Гигиеническая антисептика
Использование перчаток
Стерильные смотровые перчатки
Техника проведения
1. Подготовка к процедуре
➢ Вымыть и осушить руки (с использованием мыла или кожного антисептика)
➢ Получить информированное согласие на выполнение процедуры
➢ Приготовить все необходимое для выполнения процедуры
➢ Постелить на кресло одноразовую салфетку
➢ Объяснить пациентке цель, ход процедуры. Помочь занять удобное положение на гинекологическом кресле
2.Выполнение процедуры
➢ Провести гигиеническую антисептику рук
➢ Надеть перчатки
➢ В правую руку взять зеркало, большим и указательным пальцем левой руки раздвинуть большие половые губы, развернуть зеркало на 90 градусов и осторожно ввести во влагалище
➢ Обнажить шейку матки. При наличии слизи ее следует удалить стерильными шариками.
➢ В правую руку взять щеточку. Щеточку ввести во влагалище под контролем глаза и ее конус осторожно направить в цервикальный канал
➢ Материал берется из зоны стыка («зона превращения») плоского и цилиндрического эпителия цервикального канала, на глубину от 0,8 до 2,5 см.
«Зона превращения» у женщин после 40 лет, а также после диатермокоагуляции и криодеструкции уходит в цервикальный канал на 2,5 см выше наружного маточного зева, что диктует необходимость взятия материала для цитологического исследования из цервикального канала на глубину 2,5 см.
➢ После ведения щеточку прижать к поверхности шейки и произвести 5 полных круговых движений- трижды по часовой стрелке и дважды против часовой стрелки
➢ Аккуратно удалить цервикс-щеточку из влагалища
➢ Осторожно извлечь зеркало из влагалища
3.Окончание процедуры
➢ Содержимое щеточки нанести на предметное стекло линейными движениями вдоль стекла, используя обе стороны щеточки
➢ Поставить идентификационный номер на стекле и сопроводительном направлении
➢ Стекло и направление поместить в разные транспортировочные емкости
➢ Салфетку, использованный материал, ИМН однократного применения поместить в емкости для сбора (дезинфекции) медицинских отходов класса Б
➢ Изделия медицинского назначения многократного применения поместить в контейнеры для дезинфекции
➢ Щеточку поместить в непрокалываемый контейнер
➢ Снять перчатки, обработать руки жидким антибактериальным мылом или кожным антисептиком.
Онкология: учебник для вузов / Вельшер Л.З., Матякин Е.Г., Дудицкая Т.К., Поляков Б.И. - 2009. - 512 с. -С. 110. Онкология: учебник для вузов / Вельшер Л.З., Матякин Е.Г., Дудицкая Т.К., Поляков Б.И. - 2009. - 512 с. - С. 135.
Онкология: учебник для вузов / Вельшер Л.З., Матякин Е.Г., Дудицкая Т.К., Поляков Б.И. - 2009. - 512 с. - С. 140.
Панченко С. В. Доклад главного онколога Ульяновской области "Состояние онкологической службы Ульяновской области в 2011 г. [Электронный ресурс]. - Режим доступа: http://yokod73.narod.ru/docum.html
Состояние онкологической помощи населению России в 2014 году. / Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. - М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИРЦ» Минздрава России, 2015. - 236 с.
Важным разделом деятельности фельдшеров является оказание медицинской помощи больным на дому. Порядок лечения больных на дому определяют врачи участковой больницы или центральной районной больницы (ЦРБ) и лишь в отдельных случаях сам фельдшер. Больных, оставленных на дому, необходимо постоянно наблюдать до их выздоровления. Особенно это относится к детям. Больных из отдаленных от ФАП населенных пунктов целесообразно госпитализировать; при оставлении же больного на дому фельдшер извещает об этом врача сельского врачебного участка и осуществляет наблюдение за больным.
При амбулаторном обслуживании больных туберкулезом фельдшер, являясь непосредственным исполнителем врачебных назначений, проводит иммунохимиопрофилактику, диспансеризацию, противоэпидемические мероприятия в очагах туберкулезной инфекции, работу по гигиеническому воспитанию и др.
Фельдшер, работающий на ФАП, должен владеть простейшими приемами реанимации на догоспитальном этапе, особенно при внезапной остановке сердца или дыхания, причинами которых могут быть тяжелые травмы, кровопотеря, острый инфаркт миокарда, отравления, утопления, электротравмы. На фельдшеров и акушеров, работающих самостоятельно, возложено также оказание неотложной медицинской помощи при острых заболеваниях и несчастных случаях. При срочном вызове фельдшер должен иметь при себе чемоданчик, укомплектованный медицинским инструментарием и медикаментами согласно перечню укладки.
Большая роль принадлежит фельдшерам в диспансеризации сельского населения. Основной целью ее является осуществление комплекса мероприятий, направленных на формирование, сохранение и укрепление здоровья населения, предупреждение развития заболеваний, снижение заболеваемости, увеличение активного творческого долголетия.
Для проведения всеобщей диспансеризации осуществляется персональный учет всего населения, проживающего в районе обслуживания поликлиники, амбулатории и ФАП, в соответствии с «Инструкцией о порядке учета ежегодной диспансеризации всего населения». В сельской местности списки жителей составляют средние медицинские работники ФАП.
Для персонального учета каждого жителя средние медицинские работники заполняют «Карту учета диспансеризации» (учебная форма № 131 /у — 86) и нумеруют ее в соответствии с номером медицинской карты амбулаторного больного (учетная форма № 025/у). После уточнения состава населения все «Карты учета диспансеризации» передают в картотеку.
Фельдшер или акушерка следят, чтобы больные, нуждающиеся в сезонном (осень, весна) противорецидивном лечении, своевременно получали его в стационаре или амбулаторно. Важное значение для снижения заболеваемости имеет надлежащая организация экспертизы временной нетрудоспособности на ФАП.
В соответствии с «Положением о заведующем фельдшерско-акушерским пунктом» заведующий ФЛП фельдшер может иметь право выдавать больничные листы, справки и другие документы медицинского характера в порядке, установленном Министерством здравоохранения Российской Федерации.
Основанием для предоставления нрава выдачи больничных листов фельдшеру является ходатайство главного врача района, в котором должны быть указаны:
Удаленность ФАП от больницы (амбулатории), к которой он приписан;
Количество обслуживаемых населенных пунктов совхоза и число работающих в них;
Состояние путей сообщения;
Стаж работы фельдшера и уровень его квалификации;
Знание и соблюдение фельдшером основ экспертиз временной нетрудоспособности и «Инструкции о порядке выдачей больничных листов». Учет выданных больничных листов фельдшер ведет в «Книге регистрации листков нетрудоспособности» (форма № 036/у) с обязательным заполнением всех ее граф.
Лечебно-профилактическая помощь женщинам и детям. На каждом ФЛП фельдшер (акушерка) ведет картотеку персонального учета женщин начиная с 18-летнего возраста, куда вносят паспортные данные, перенесенные заболевания, сведения о всех беременностях (годы, чем заканчивалась каждая беременность, осложнения). Обследование каждой беременной при первом обращении фельдшер (акушерка) начинает с общего осмотра, измеряет длину и массу тела, артериальное давление на общих руках, в пределах своей компетенции определяет состояние сердца, легких и других органов, исследует мочу на белок. Осуществляя наблюдение за беременными, фельдшер (акушерка) ФАП обязан каждую из них показать врачу; в случаях, когда у женщины обнаруживаются малейшие отклонения от нормального развития беременности, она должна быть немедленно направлена к врачу.
Одним из важных разделов деятельности фельдшеров ФАП является проведение при возникновении очагов инфекционных заболеваний первичных противоэпидемических мероприятий, от своевременности и качества которых зависит эффективность предупреждения распространения инфекции за пределы возникшего очага. В связи с этим большое значение имеет организация деятельности работников ФЛП, направленная на выявление инфекционных заболеваний среди населения.
При установлении диагноза инфекционного заболевания (или подозрении на него) средний медицинский персонал ФАП должен:
Провести первичные противоэпидемические мероприятия в очаге;
Изолировать больного на дому и организовать текущую дезинфекцию до госпитализации больного;
Выявить всех лиц, контактировавших с больным, взять их на учет и установить за ними медицинское наблюдение;
Осуществить (совместно с врачом) карантинные мероприятия в отношении контактировавших с больными лиц, посещающих детские дошкольные учреждения, школы или работающих на эпидемически важных объектах;
Сообщить по месту работы, учебы, в детские дошкольные учреждения, по месту жительства о заболевшем и контактировавших с ним лицах;
По указанию педиатра или эпидемиолога провести гаммаглобулино-профилактику контактировавших с больным вирусным гепатитом А.
Инфекционного больного госпитализируют в течение первых суток заболевания на специальном транспорте. При его отсутствии больного можно перевозить на любом транспорте с последующей дезинфекцией. В дальнейшем медицинский работник ФАП выполняет указания эпидемиолога (помощника эпидемиолога) и осуществляет:
Собирание материала у лиц, контактировавших с больными, для лабораторного исследования с целью выявления бактерионосителей;
Прививки по эпидемиологическим показаниям и химиопрофилактику;
Динамическое наблюдение за лицами, контактировавшими с больными, в течение срока инкубационного периода, данного инфекционного заболевания.
Большую роль играют фельдшеры и акушерки ФАП в проведении оздоровительных мероприятий, гигиеническом воспитании сельского населения и пропаганде здорового образа жизни. Чтобы правильно оценить уровень благополучия объекта, фельдшеров обучают простейшим лабораторным анализам, экспресс-методам и снабжают их походными экспресс-лабораториями. С помощью такой лаборатории можно определять остаточные количества хлора в дезинфицирующих растворах, на предметах и поверхностях (йодокрахмальный метод), остаточные количества моющих средств на столовой посуде (проба с фенолфталеином).
Фельдшеру ФАП часто приходится принимать участие в анализе производственного травматизма и разработке мероприятий по его снижению, поэтому он должен быть хорошо знаком с основными причинами возникновения травматизма: техническими, организационными и санитарно-гигиеническими. Более половины всех пострадавших обращаются на ФАП, поэтому от среднего медицинского персонала требуется постоянное совершенствование знаний, в частности, по оказанию первой помощи при травмах. Кроме оказания первой помощи пострадавшему, фельдшеры ФАП осуществляют регистрацию и учет травм; выявляют, изучают и анализируют их причины в зависимости от различных факторов; совместно с врачами разрабатывают конкретные мероприятия по устранению выявленных причин; осуществляют контроль за соблюдением правил техники безопасности; обучают работников сельского хозяйства приемам оказания первой помощи.
При работе в составе врачебной бригады фельдшер во время выполнения вызова полностью подчиняется врачу. Его задача — четко и быстро выполнять все назначения. Ответственность за принимаемые решения лежит на враче. Фельдшер должен владеть техникой подкожных, внутримышечных и внутривенных инъекций и регистрации ЭКГ, уметь быстро установить систему для капельного введения жидкости, измерить АД, сосчитать пульс и число дыхательных движений, ввести воздуховод, провести сердечно-легочную реанимацию и др. Он должен также уметь наложить шину и повязку, остановить кровотечение, знать правила транспортировки больных.
В случае самостоятельной работы фельдшер «Скорой помощи» полностью отвечает за все, поэтому он должен в полном объеме владеть методами диагностики на догоспитальном этапе. Ему необходимы знания по неотложной терапии, хирургии, травматологии, гинекологии, педиатрии. Он должен знать основы токсикологии, уметь самостоятельно принять роды, оценить неврологическое и психическое состояние больного, не только зарегистрировать, но и ориентировочно оценить ЭКГ.
Приложение № 10 к приказу МЗ РФ № 100 от 26.03.99
«Положение о фельдшере выездной бригады скорой медицинской помощи»
I. Общие положения
1.1. На должность фельдшера бригады «Скорой медицинской помощи» назначается специалист со средним медицинским образованием по специальности «Лечебное дело», имеющий диплом и соответствующий сертификат.
1.2. При выполнении обязанностей по оказанию скорой медицинской помощи в составе фельдшерской бригады фельдшер является ответственным исполнителем всей работы, а в составе врачебной бригады действует под руководством врача.
1.3. Фельдшер выездной бригады «Скорой медицинской помощи» руководствуется в работе законодательством Российской Федерации, нормативными и методическими документами Министерства здравоохранения Российской Федерации, Уставом станции «Скорой медицинской помощи», приказами и распоряжениями администрации станции (подстанции, отделения), настоящим Положением.
1.4. Фельдшер выездной бригады «Скорой медицинской помощи» назначается на должность и увольняется в установленном законом порядке.
II. Обязанности
Фельдшер выездной бригады «Скорой медицинской помощи» обязан:
2.1. Обеспечивать немедленный выезд бригады после получения вызова и прибытие ее на место происшествия в пределах установленного временного норматива на данной территории.
2.2. Оказывать скорую медицинскую помощь больным и пострадавшим на месте происшествия и во время транспортировки в стационары.
2.3. Вводить больным и пострадавшим лекарственные препараты по медицинским показаниям, осуществлять остановку кровотечения, проводить реанимационные мероприятия в соответствии с утвержденными отраслевыми нормами, правилами и стандартами для фельдшерского персонала по оказанию скорой медицинской помощи.
2.4. Уметь пользоваться имеющейся медицинской аппаратурой, владеть техникой наложения транспортных шин, повязок и методами проведения базовой сердечно-легочной реанимации.
2.5. Владеть техникой снятия электрокардиограмм.
2.6. Знать дислокацию лечебно-профилактических учреждений и районы обслуживания станции.
2.7. Обеспечивать переноску больного на носилках, в случае необходимости принять в ней участие (в условиях работы бригады переноска больного на носилках расценивается как вид медицинской помощи). При транспортировке больного находиться рядом с ним, осуществляя оказание необходимой медицинской помощи.
2.8. При необходимости транспортировки больного в бессознательном состоянии или состоянии алкогольного опьянения произвести осмотр на предмет обнаружения документов, ценностей, денег с указанием в «Карте вызова», сдать их в приемное отделение стационара с отметкой в направлении под роспись дежурного персонала.
2.9. При оказании медицинской помощи в чрезвычайных ситуациях, в случаях повреждений насильственного характера действовать в установленном законом порядке (сообщить в органы внутренних дел).
2.10. Обеспечивать инфекционную безопасность (соблюдать правила санитарно-гигиенического и противоэпидемического режима). При выявлении у больного карантинной инфекции оказать ему необходимую медицинскую помощь, соблюдая меры предосторожности, и информировать старшего врача смены о клинико-эпидемиологических и паспортных данных больного.
2.11. Обеспечить правильное хранение, учет и списание лекарственных препаратов.
2.12. По окончании дежурства проверить состояние медицинской аппаратуры, транспортных шин, пополнить израсходованные в процессе работы лекарственные средства, кислород, закись азота.
2.13. Информировать администрацию станции «Скорой медицинской помощи» о всех чрезвычайных происшествиях, возникших в период выполнения вызова.
2.14. По требованию сотрудников внутренних дел остановиться для оказания скорой медицинской помощи, независимо от места нахождения больного (пострадавшего).
2.15. Вести утвержденную учетную и отчетную документацию.
2.16. В установленном порядке повышать свой профессиональный уровень, совершенствовать практические навыки.
III. Права
Фельдшер выездной бригады «Скорой медицинской помощи» имеет право:
3.1. Вызвать в случае необходимости на помощь врачебную бригаду «Скорой медицинской помощи».
3.2. Вносить предложения по совершенствованию организации и оказания скорой медицинской помощи, улучшению условий труда медицинского персонала.
3.3. Повышать свою квалификацию по специальности не реже одного раза в пять лет. Проходить в установленном порядке аттестацию и переаттестацию.
3.4. Принимать участие в работе медицинских конференций, совещаний, семинаров, проводимых администрацией учреждения.
IV. Ответственность
Фельдшер выездной бригады «Скорой медицинской помощи» несет ответственность в установленном законодательством порядке:
4.1. За осуществляемую профессиональную деятельность в соответствии с утвержденными отраслевыми нормами, правилами и стандартами для фельдшерского персонала «Скорой медицинской помощи».
4.2. За противоправные действия или бездействие, повлекшие за собой ущерб здоровью пациента или его смерть.
В соответствии с приказом МЗ РФ № 100 выездные бригады подразделяются на фельдшерские и врачебные. Фельдшерская бригада включает в свой состав двух фельдшеров, санитара и водителя. Врачебная бригада включает врача, двух фельдшеров (либо фельдшера и медицинскую сестру-анестезиолога), санитара и водителя.
Тактика поведения фельдшера «Скорой помощи» во время выполнения вызова. Персонал «Скорой помощи», в том числе и фельдшеры, работает в очень сложных условиях. Во время выполнения вызова фельдшер может столкнуться с любой, самой неожиданной патологией. Ему необходимо иметь широкий кругозор, обладать знаниями из самых разных областей медицины, уметь быстро ориентироваться в сложной ситуации, сохранять хладнокровие, за короткое время принять верное решение. Для этого недостаточно одной только специальной подготовки, требуются еще и определенные моральные качества, хорошее здоровье и жизненный опыт.
Одна из главных сложностей состоит в том, что в момент выезда на вызов никогда абсолютно точно неизвестно, что ждет впереди. «Сердечный приступ» может обернуться чем угодно — от истерики до отравления таблетками, а при выезде по поводу травмы руки на месте может оказаться больной с огнестрельным ранением, массивной кровопотерей и шоком. Поэтому фельдшер должен быть постоянно готов к любым ситуациям. Но не следует длительно поддерживать себя в состоянии нервного напряжения — надо уметь быстро ориентироваться и мобилизовываться, прибыв на место.
Уже подъезжая к месту вызова, необходимо начать наблюдать и делать выводы. Встречают вас или нет; как выглядят встречающие — обеспокоены, заплаканы, встревожены или безразлично-неторопливы; не находятся ли они в состоянии алкогольного опьянения, не выглядят ли странно для данных обстоятельств. Общих законов нет, но, как правило, когда случается что-то действительно серьезное, «Скорую» встречают еще на улице. Необычное поведение может натолкнуть на мысль о неискренности вызывавших. В случае выезда по заведомо криминальному поводу (драки, массовые беспорядки и т.п.) надо затребовать милицейское сопровождение.
Встречающего следует пропустить вперед, пусть он показывает дорогу. По дороге следует начать расспрос, чтобы уточнить, что случилось.
Прибыв к больному, надо быстро оценить обстановку. Сбор анамнеза в условиях скорой помощи имеет свои особенности. Его следует проводить целенаправленно. Не стоит в самом начале допускать пространные рассказы об истории жизни, замужества и множестве хронических недугов. Следует выяснить, что случилось именно сейчас, все остальное — потом и при необходимости. Часто хронических больных, злоупотребляющих «Скорой помощью» без достаточных оснований, это ставит в тупик. В то же время и человек действительно серьезно больной может растеряться, испугаться, не суметь сразу подобрать слова. Такому надо помочь. Не следует не только идти на поводу у больного, но также и подавлять его, подгонять его жалобы под свое (возможно, неверное) представление о характере заболевания. Следует обязательно спросить, с чем связывает сам больной свое состояние, но его ответ оценить критически.
После выяснения картины происшедшего нужно выяснить, возникло ли данное состояние впервые или подобное уже случалось, что тогда помогло, какой был поставлен диагноз, какими еще заболеваниями страдает больной, имеются ли какие-нибудь медицинские документы (амбулаторная карта, выписки из стационаров, результаты обследований).
Одновременно со сбором анамнеза надо начинать осмотр (сосчитать пульс, измерить АД, пропальпировать живот и др.).
Если маленький ребенок спит, лучше вначале осторожно пропальпировать живот, а уже затем будить его и проводить дальнейший осмотр. Осматривать зев у беспокойных детей следует в последнюю очередь, так как эта неприятная процедура может надолго затруднить контакт с ребенком.
При травмах следует сначала осмотреть место повреждения, одновременно оценив общее состояние больного, а затем переходить к обследованию по органам и системам.
На сбор анамнеза и осмотр в условиях скорой помощи отводится 5—10 минут. Но иногда нет и их! После этого надо делать выводы, ставить предварительный диагноз и принимать решение в отношении оказания помощи.
У постели больного следует вести себя доброжелательно, корректно, но деловито и твердо. Нельзя допускать по отношению к себе панибратства или снисходительного отношения со стороны родственников или больного, тем более — грубости. Все действия при этом должны быть четкими, уверенными, необходимо всем своим видом внушать больному спокойствие.
Прежде чем делать инъекции или давать таблетки, необходимо выяснить, нет ли у больного аллергии на данные препараты.
Особенно трудны в моральном плане бывают вызовы на улицу или в иное общественное место по поводу автоаварий, падений с высоты или внезапных тяжелых заболеваний, когда вокруг собирается разгоряченная толпа, как правило, негативно или даже агрессивно настроенная по отношению к сотрудникам «Скорой помощи». Люди в такой ситуации неадекватно оценивают происходящее. На месте происшествия могут оказаться и другие сотрудники «Скорой помощи». К их советам следует прислушаться, принять помощь. Во время транспортировки в стационар не следует брать в машину более одного сопровождающего. Если же приходится госпитализировать пьяного или агрессивного больного, его следует положить или посадить так, чтобы он не мог неожиданно и быстро дотянуться до фельдшера. Если машина «Скорой помощи» была остановлена по дороге на вызов для оказания помощи другому больному и она ему действительно нужна, следует сообщить диспетчеру, чтобы первый вызов передали для выполнения другой бригаде.
После того как медицинская помощь уже оказана, следует объяснить больному, что же все-таки с ним произошло, как вести себя в подобном случае в следующий раз, дать в общих чертах рекомендации по лечению и профилактике данного заболевания. В случае необходимости следует передать активный вызов участковому врачу (когда больной по какой-либо причине не госпитализирован, но требует динамического наблюдения) или врачебной бригаде (когда больной в тяжелом состоянии требует специализированной помощи или картина заболевания не полностью ясна, и вы не уверены в диагнозе).
Принцип работы фельдшера (да и врача) «Скорой помощи» — гипердиагностика. Тяжесть состояния больного лучше переоценить, чем недооценить.
Методы и средства санитарно-просветительной работы фельдшера
В организации своей санитарно-просветительной работы фельдшер наряду с традиционными методами обучения населения по вопросам охраны здоровья (такими, как собеседование, групповые дискуссии, лекции, тематические вечера, вечера вопросов и ответов, беседы за круглым столом, устные журналы, школы здоровья, публикации в прессе, конференции) широко использует и методы наглядной агитации: стенгазеты; санбюллетени; выставки и уголки здоровья; книжные выставки.
Санитарный бюллетень — это иллюстрированная санитарно-просветительная газета, посвященная только одной теме. Тематика должна быть актуальной и выбираться с учетом задач, стоящих перед современным здравоохранением, а также сезонности и эпидемиологической обстановки в данном регионе. Заголовок выделяется крупным шрифтом. Название должно быть интересным, интригующим, желательно при этом не упоминать слово «болезнь» и «профилактика».
Санбюллетень состоит из двух частей — текстовой и иллюстрированной. Текст размещают на стандартном листе ватмана в виде колонок, шириной 13—15 см, печатают на машинке или компьютере. Разрешается написание текста каллиграфическим почерком пастой черного или фиолетового цвета. Нужно выделить передовую статью или введение, остальной текст должен быть разбит на подразделы (рубрики) с подзаголовками, в которых излагают суть вопросов и дают практические советы. Заслуживает внимания подача материала в виде вопросов и ответов. Текст должен быть написан доходчивым для широкой массы языком без медицинской терминологии, с обязательным использованием местного материала, примеров правильного гигиенического поведения по отношению к своему здоровью, случаев из врачебной практики. Художественное оформление: рисунки, фотографии, аппликации должны иллюстрировать материал, но не дублировать его. Рисунок может быть один или несколько, но один из них — основной — должен нести главную смысловую нагрузку и привлечь внимание. Текст и художественное оформление не должны быть громоздкими. Санитарный бюллетень заканчивается лозунгом или призывом.
Необходимо обеспечить выпуск санитарного бюллетеня не реже 1—2 раз в квартал.
Уголок здоровья. Организации уголка должна предшествовать определенная подготовительная работа: согласование с руководством данного учреждения; определение перечня работ и необходимых строительных материалов (стенды, планки, кнопки, клей, ткань и др.); выбор места — такого, где постоянно или часто бывает масса людей; подборка соответствующего иллюстрированного материала (плакаты, фото- и литературные выставки, диапозитивы, фотографии, памятки, листовки, вырезки из газет и журналов, рисунки).
Ведущая тематика уголка здоровья — различные аспекты здорового образа жизни. В случае появления какой-либо инфекции или ее угрозы в данной местности, в уголке должен быть помещен соответствующий материал по профилактике. Это могут быть санитарный бюллетень, листовка, подготовленная местным органом санитарно-эпидемиологического надзора, краткая памятка, вырезка из медицинской газеты и т.п. Уголок здоровья должен иметь доску вопросов и ответов. Ответы на вопросы должны быть всегда своевременны, оперативны и полезны.
Устные журналы. В устных журналах, помимо медработников, должны участвовать работники ГИБДД, инспекторы по делам несовершеннолетних, юристы. В своих сообщениях они выступают но вопросам не только медицинского характера, но и затрагивающим правовые, социальные и нравственные проблемы. Поэтому в устных журналах можно рассматривать сразу несколько тем.
Диспуты и конференции. Диспут — метод полемического обсуждения какой-либо актуальной, нравственной или воспитательной проблемы, способ коллективного поиска, обсуждения и разрешения волнующих население вопросов. Диспут возможен, когда хорошо подготовлен, когда в нем участвуют не только специалисты, но и (например, в школе) учащиеся, учителя. Столкновения, борьба мнений связаны с различиями во взглядах людей, жизненном опыте, в запросах, вкусах, знаниях, в умении подходить к анализу явлений. Цель диспута состоит в том, чтобы поддержать передовое мнение и убедить всех в правоте.
Формой пропаганды, близкой к диспуту, является конференция с заранее разработанной программой и фиксированными выступлениями как специалистов, так и самого населения.
К устным формам санитарно-просветительной пропаганды также относят тематические вечера, беседы за круглым столом, вечера вопросов и ответов. Большую роль в пропаганде здорового образа жизни могут играть театрально-зрелищные мероприятия, массовые спортивные мероприятия. Содержание работы при проведении различных форм и методов гигиенического воспитания населения и пропаганды здорового образа жизни на ФАПе должно быть направлено на освещение основ личной и общественной гигиены, гигиены села, поселка, жилища, благоустройства и озеленения, содержания приусадебных участков; на борьбу с загрязнением окружающей среды; профилактику заболеваний, вызываемых воздействием на организм неблагоприятных метеорологических условий (повышенная влажность воздуха, высокие и низкие температуры и другие); на внедрение физической культуры в быт каждого человека. В круг тем этой деятельности входит также трудовая и профессиональная ориентация: создание здоровых бытовых и производственных условий, формирование здорового образа жизни. Большое внимание необходимо уделять профилактике инфекционных заболеваний, улучшению водоснабжения и водопользования. Одной из важных задач является пропаганда мер гигиены труда при сельскохозяйственных работах, предупреждение сельскохозяйственного травматизма и отравлений ядохимикатами, разъяснение гигиенических требований к доставке, очистке и хранению воды в полевых условиях. Значительное место должна занять противоалкогольная пропаганда, разъяснение вреда курения. Курение является одним из наиболее распространенных видов наркомании. Работа фельдшера по антиалкогольной пропаганде должна строиться по определенной системе, включая правовые, медико-биологические и нравственные аспекты.
В зависимости от пола и возраста можно подбирать темы для лучшего восприятия слушателями.
Примерные планы лекций
1. Для мужчин: влияние алкоголя на все органы и системы организма; алкоголь и травматизация; алкоголь и венерические заболевания; алкоголь и смертность; алкоголь и трудоспособность; алкоголь и семья; алкоголь и наследственность; экономический ущерб, наносимый государству от лиц, злоупотребляющих алкоголем.
2. Для женщин: влияние алкоголя на организм женщины; влияние алкоголя на беременность; алкоголь и дети; роль женщины в укреплении семьи и преодолении пьянства мужчин.
3. Для подростков: анатомо-физиологические особенности организма подростка; влияние алкоголя на организм подростка; влияние алкоголя на способности подростка; влияние алкоголя на потомство; алкоголь и нарушение правопорядка; как сохранить психическое здоровье.
Большой раздел профилактической работы по воспитанию здорового образа жизни нужно выделить в педиатрии. Гигиеническое обучение и воспитание начинается с раннего детства, при антенатальной охране будущего потомства.
Воспитание здорового образа жизни и профилактику различных заболеваний целесообразно проводить с беременными на дородовых патронажах и групповых занятиях в форме индивидуальных бесед (например, в «Школе беременных женщин»). Беседы о гигиене беременной женщины и особенностях периода новорожденное™ желательно проводить не только среди самих женщин, но и среди членов их семей, особенно мужей в «Школе молодых отцов».
Необходимость проведения широких профилактических мер в отношении детского населения и юношества, включая прежде всего меры воспитательного и санитарно-просветительного характера, увеличивается и в связи с тем, что в этом возрасте формируются основные поведенческие установки, взгляды, навыки, привычки и др, т. е. все то, что в дальнейшем определяет образ жизни человека. В этот период можно предупредить возникновение вредных привычек, эмоциональной невоздержанности, установки на пассивный отдых и нерациональное питание, которые в дальнейшем могут стать фактором риска для многих заболеваний. У детей сравнительно легко воспитать привычку к двигательной активности, занятия физкультурой и спортом, разнообразному и умеренному питанию, рациональному режиму.
Санитарно-просветигельная работа на ФАПе должна проводиться но заранее составленному плану. Составление плана санитарно-просветительной работы проводят на весь текущий год и на месяц. В годовом плане предусматривают основные задачи по охране здоровья и воспитанию здорового образа жизни, а на каждый месяц составляют конкретный план с названиями тем и методами их освещения. В конце месяца и в конце отчетного года медицинский работник обязан отчитаться за проделанную санитарно-просветительную работу.
Гигиеническое воспитание населения и пропаганда здорового образа жизни должна способствовать ранней обращаемости за медицинской помощью, улучшению показателей родовспоможения, снижению детской смертности, заболеваемости с временной утратой трудоспособности и травматизма, своевременной госпитализации больных, привлечению населения на профилактические осмотры, повышению уровня санитарной культуры населения, оздоровлению условий их труда и быта, активизации творческой самодеятельности людей в вопросах сохранения и укрепления здоровья, повышению работоспособности и творческого долголетия.
Иммунопрофилактика инфекционных болезней это система мероприятий, осуществляемых в целях предупреждения, ограничения распространения и ликвидации инфекционных болезней путем проведения профилактических прививок согласно Национальному календарю профилактических прививок, устанавливающему сроки и порядок проведения гражданам профилактических прививок.
В ходе работы над данной темой мной была сформулирована цель и задачи настоящего исследования:
Цель: определить роль фельдшера в организации специфической профилактики инфекционных заболеваний у детей.
Для достижения указанной цели необходимо выполнить следующие задачи:
- Изучить историю развития иммунопрофилактики;
- Изучить организационную систему иммунопрофилактики;
- Изучить национальный календарь прививок;
- Изучить возможные реакции, осложнения, а также противопоказания к прививкам, входящим в национальный календарь прививок;
- Определить роль фельдшера в организации специфической профилактики инфекционных заболеваний у детей;
- Провести анкетирование родителей по вопросу их отношения к иммунопрофилактике;
- Провести анализ, полученных в результате исследования данных;
- На основании проведенного исследования предложить методы повышения эффективности работы фельдшера в отношении иммунопрофилактики.
Экспертами Всемирной организации здравоохранения вакцинация признана наиболее безопасным, экономически целесообразным и высокоэффективным средством профилактики инфекционных заболеваний. Активная иммунизация является самым главным, прогрессивным и быстро развивающимся направлением профилактической медицины. В XXI веке во всем мире отмечается рост приверженности к вакцинации, что связано с разработкой новых вакцин и возлагаемыми на них большими надеждами в профилактике опасных инфекционных заболеваний.
Федеральный закон №157 от 4 сентября 1998 года (с изменениями на 21 декабря 2013 года) «Об иммунопрофилактике инфекционных болезней» устанавливает правовые основы государственной политики в области иммунопрофилактики инфекционных болезней, осуществляемой в целях охраны здоровья и обеспечения санитарно-эпидемиологического благополучия населения Российской Федерации. В статье 5 настоящего закона « Права и обязанности граждан при осуществлении иммунопрофилактики» указано, что граждане при осуществлении иммунопрофилактики имеют право на: «получение от медицинских работников полной и объективной информации о необходимости профилактических прививок, последствиях отказа от них, возможных поствакцинальных осложнениях». Из этого следует, что фельдшер обязан давать родителям разъяснения по всем вышеперечисленным вопросам и, кроме того, не зависимо от того, проявляют ли к данному вопросу интерес сами родители, предупреждать их о возможных последствиях.
Объектом данного исследования являются дети, которые подлежали иммунопрофилактике, согласно Национальному календарю прививок.
Предметом исследования является роль, которую оказывает фельдшер в организации специфической профилактики инфекционных заболеваний у детей, а также роль фельдшера в формировании позитивного отношения родителей к активной иммунизации.
1. Краткий обзор истории иммунологии
По происхождению иммунология прикладная медицинская наука. Ее предыстория насчитывает более 2 тыс. лет. На протяжении этого времени основным подходом в данной области был эмпирический поиск путей предотвращения инфекционных заболеваний. В основе такого поиска было достоверное наблюдение о том, что люди, перенесшие некоторые « заразные болезни » , повторно ими не заболевали. Ярко и очевидно этот факт проявлялся при оспе именно это заболевание стало « плацдармом » для формирования иммунологии.
Описано предупреждение развития оспы у наследника китайского императора с помощью нанесения на слизистую носа материала из пустул людей, выздоравливающих от оспы. Это первое письменное свидетельство, которое однозначно можно отнести к области иммунологии (около 1 тыс. лет до н.э.). Профилактический опыт в данном случае был успешным. Подобный подход, позже названный европейцами вариоляцией (от лат. variola оспа), был, по-видимому, независимо разработан в разных вариантах во многих регионах Азии.
Надо признать, что вариоляция несла значительный риск и нередко приводила к развитию заболевания и смерти, что в конце концов было осознано европейцами, не готовыми жертвовать даже единичными гражданами ради абстрактного прогресса (в азиатской традиции с большей
легкостью относятся к индивидуальным утратам). Вариоляция была запрещена в большинстве стран.
В 90-х годах XVIII века английский врач Э. Дженнер (E. Jenner), работавший в сельской скотоводческой местности, сделал наблюдение, что коровницы, контактировавшие со скотом, больным коровьей оспой, если и заболевали человеческой оспой, то переносили ее легко. Основываясь на этом подтвержденном, но все-таки эмпирическом факте, Э. Дженнер предпринял рискованный эксперимент на человеке: он привил коровью оспу от заболевшей ею коровницы 8-летнему Джеймсу Фиппсу. Реакция на прививку проявилась в виде кратковременного недомогания. Повторная прививка коровьей оспы дала еще более слабую реакцию. После этого Дженнер предпринял шаг, который в настоящее время мог бы быть расценен как преступление: привил подростку материал от больного человеческой оспой. Заболевание не развилось.
Отчет об этом успешном опыте вакцинации (от латинского vacca корова) был опубликован в научной прессе в 1796 г. Однако эту публикацию нельзя расценивать как начало иммунологии, поскольку речь в ней шла о конкретной профилактической процедуре, а не об общих принципах и правилах, которые можно было бы расценивать как фундамент новой науки. На протяжении XIX века вакцинация приобрела широкое распространение в цивилизованном мире и применялась в практически неизменном виде до недавнего времени, когда международное сообщество признало факт элиминации оспы (1980).
Рождение иммунологии как науки связано с именем Л. Пастера. Широко известно, что Л. Пастер создал микробиологию и доказал роль микроорганизмов в развитии и распространении инфекционных заболеваний. Он же сформулировал общие принципы иммунологической профилактики инфекционных заболеваний, что рассматривают как отправную точку иммунологии как самостоятельной науки. В качестве точки отсчета ее существования принимают 1880 г., когда были опубликованы результаты исследований Л. Пастера по созданию и успешному испытанию живой ослабленной вакцины против куриной холеры. Суть экспериментов состояла в том, что курам прививали вибрионы куриной холеры, долгое время культивированные в неблагоприятных условиях, что не вызывало у животных заболевания и в то же время предотвращало развитие заболевания при последующем введении активных возбудителей холеры кур, убивавших невакцинированных птиц. Фактически был получен результат, сходный с результатом Э. Дженнера, но с двумя существенными различиями. Во-первых, Л. Пастер ставил эксперимент на птицах, а не на человеке. Во-вторых, профилактический эффект основывался не на « перекрестной защите » , индуцированной предварительным введением родственного, но иного инфекционного агента, а на сознательно разработанной процедуре « ослабления » (аттенуации) возбудителя, используемого для профилактической иммунизации. Тем не менее термин « вакцинация » применяют ко всем типам профилактики, основанным на предварительном введении инфекционного материала, возбудителя или его молекул.
В результате этого исследования Л. Пастер ввел еще один, более значимый термин иммунитет (лат. Immunitas освобождение) снижение вероятности развития инфекционного заболевания после повторного заражения, т.е. после ранее перенесенной инфекции.
Серия исследований Л. Пастера привела к созданию вакцин против сибирской язвы и краснухи свиней.
В ближайшие десятилетия после открытий Л. Пастера в результате интенсивной деятельности в основном французско-русской и немецкой школ были достигнуты успехи в развитии прикладной иммунологии и заложены основы иммунологической теории.
Первыми следует упомянуть работы И.И. Мечникова, открывшего фагоцитоз и интерпретировавшего его как фундаментальный механизм иммунитета. В это время был создан ряд новых вакцин, причем не только учениками Л. Пастера, но и немецкими учеными, тяготевшими, главным образом, к школе Р. Коха. В этом ряду надо выделить работы Э. Беринга, показавшего (совместно с С. Китазато, 1890) возможность иммунизации против инактивированных токсинов (анатоксинов) и « переноса иммунитета » с сывороткой крови. Фактически опыт с переносом иммунитета послужил первым свидетельством существования антител гуморальных факторов, опосредующих специфичный в отношении возбудителя инфекционного заболевания иммунитет. Термин « антитело » ввел П. Эрлих в 1891 г.
Ученые один за другим описывали новые иммунологические феномены и факторы. И.И. Мечников первым стал говорить о существовании иммунной системы, функция которой формирование и осуществление реакций иммунитета. Л. Дейтч ввел термин «антиген» (1903) для обозначения веществ, на которые реагирует иммунная система, обеспечивая их удаление из организма. Разработав способ окрашивания клеток, П. Эрлих описал основные разновидности лейкоцитов, которые уже тогда считали эффекторными (исполнительными) клетками иммунитета.
К началу ХХ века существовало 2 основных теоретических направления в иммунологии клеточное, созданное И.И. Мечниковым, и гуморальное, родоначальником которого был П. Эрлих.
2. Анатомо-физиологические особенности лимфатической и иммунной систем у детей
В систему органов, обеспечивающих иммунитет входят вилочковая железа(тимус), селезёнка, лимфатические узлы, лимфоидные образования желудочно-кишечного тракта, лимфоидное глоточное кольцо, лимфоцит костного мозга и периферической крови.
Лимфоидная система состоит из вилочковой железы, селезенки, лимфатических сосудов и циркулирующих лимфоцитов. К лимфоидной системе относятся и скопления лимфоидных клеток в миндалинах, пейеровых бляшках подвздошной кишки.
Вилочковая железа является главным органом лимфоидной системы, растет в период внутриутробного развития, в постнатальном периоде, достигает максимальной массы к 6-12 годам и в последующие годы происходит постепенная инволюция.
Селезенка увеличивается в течение всех периодов детства, роль ее до конца остается невыясненной, при ее удалении по каким-то причинам у детей обнаруживается склонность к частым инфекционным заболеваниям.
Лимфатические узлы представляют собой мягкие эластические образования бобовидной или лентовидной формы, располагающиеся группами по ходу лимфатических сосудов. Размеры их колеблются от 1 до 20 мм. Капсула и трабекулы представлены соединительной тканью, вещество соединительной тканью и паренхимой, состоящей из макрофагов, лимфоцитов в различных стадиях развития, плазматических клеток. Выполняют барьерную и гемопоэтическую функции. Лимфатические узлы начинают формироваться у плода со 2-го месяца внутриутробного развития и продолжают развиваться в постнатальном периоде. У новорожденных и детей первых месяцев жизни недостаточно сформированы капсула и трабекулы, в связи с чем в этом возрасте лимфатические узлы у здоровых детей не пальпируются. К 2-4 годам лимфоидная ткань (в том числе и лимфатические узлы) развиваются бурно, переживая период физиологической гиперплазии. Однако их барьерная функция выражена
недостаточно, чем объясняются более вероятные процессы генерализации инфекции в этом возрасте. У детей школьного возраста строение и функции лимфатических узлов стабилизируются, к 10 годам достигается их максимальное количество, соответствующее взрослым людям.
У здорового ребенка пальпируются не более 3-х групп лимфатических узлов (шейные, паховые и подмышечные). По своей характеристике они единичные мягкие безболезненные, подвижные, не спаянные между собой и с подлежащими тканями.
К 1 году жизни лимфатические узлы у детей уже можно пропальпировать у большинства детей. Вместе с постепенным увеличением объёма происходит их дальнейшая дифференцировка.
К 3 годам жизни тонкая соединительнотканная капсулах хорошо выражена, содержит медленно разрастающиеся ретикулярные клетки. К 7-8 годам в лимфатическом узле с выраженной ретикулярной стромой начинают постепенно формироваться трабекулы, прорастающие в определённых направлениях и образующие остов узла. К 12-13 годам лимфатический узел имеет законченное строение: хорошо развитую соединительнотканную капсулу, трабекулы, фолликулы, более узкие синусы и менее обильную ретикулярную ткань, зрелый клапанный аппарат. У детей лимфатические узлы, расположенные рядом, соединены друг с другом многочисленными лимфатическими сосудами.
В период полового созревания рост лимфатических узлов останавливается, они частично подвергаются обратному развитию. Максимальное количество лимфатических узлов насчитывают к 10 годам.
Реакцию лимфатических узлов на различные (чаще всего инфекционные) агенты выявляют у детей начиная с 3-го месяца жизни. В 1-2 года барьерная функция лимфатических узлов низкая, что объясняет частую в этом возрасте генерализацию инфекции.
В преддошкольном периоде лимфатические узлы уже могут служить механическим барьером и отвечать на присутствие возбудителей инфекционных болезней воспалительной реакцией. У детей этого возраста часто возникают лимфадениты, в том числе гнойные и казеозные (при туберкулёзе).
К 7-8 годам становится возможным подавление инфекции в пределах лимфатического узла. В этом возрасте и у более старших детей патогенные микроорганизмы поступают в лимфатические узлы, но не вызывают нагноения или других специфических изменений.
Доступны пальпации следующие группы периферических лимфатических узлов.
1. Шейные лимфатические узлы:
Затылочные, расположенные на буграх затылочной кости; собирают лимфу с кожи волосистой части головы и задней части шеи.
Сосцевидные, расположенные за ушами в области сосцевидного отростка, и околоушные, локализованные впереди уха на околоушной слюнной железе; собирают лимфу из среднего уха, с кожи, окружающей ухо, ушных раковин и наружного слухового прохода.
Поднижнечелюстные, расположенные под ветвями нижней челюсти; собирают лимфу с кожи лица и слизистой оболочки дёсен.
Подбородочные (обычно по одному с каждой стороны) собирают лимфу с кожи нижней губы, слизистой оболочки дёсен и области нижних резцов.
Переднешейные, расположенные кпереди от грудино-ключично-сосцевидной мышцы , преимущественно в верхнем шейном треугольнике; собирают лимфу с кожи лица, от околоушной железы, слизистых оболочек носа, зева и рта.
Заднешейные, расположенные по заднему краю грудино-ключично-сосцевидной мышцы и перед трапециевидной мышцей, преимущественно в нижнем шейном треугольнике; собирают лимфу с кожи шеи и частично гортани.
Надключичные, расположенные в области надключичных ямок; собирают лимфу с кожи верхней части груди, плевры и верхушек лёгких.
2. Подключичные, расположенные в подключичных областях; собирают лимфу с кожи грудной клетки и плевры.
3. Подмышечные, расположенные в подмышечных ямках; собирают лимфу с кожи верхних конечностей, за исключением III, IV, V пальцев и внутренней поверхности кисти.
4. Торакальные, расположенные кнутри от передней подмышечной линии под нижним краем грудной мышцы , собирают лимфу с кожи грудной клетки, париетальной плевры, частично от лёгких и грудных желёз.
5. Локтевые, или кубитальные, расположенные в желобке двуглавой мышцы; собирают лимфу с кожи III, IV, V пальцев и внутренней поверхности кисти.
6. Паховые, расположенные по ходу паховой связки; собирают лимфу с кожи нижних конечностей, нижней части живота, ягодиц, промежности, от половых органов и заднего прохода.
7. Подколенные, расположенные в подколенной ямке; собирают лимфу с кожи стопы.
Знание расположения лимфатических узлов и направления лимфатических сосудов, отводящих и приводящих лимфу, помогает в определении входных ворот инфекции и источника очаговых поражений, так как на месте внедрения патологического агента иногда не обнаруживают никаких изменений, в то время как регионарные лимфатические узлы оказываются увеличенными и болезненными.
Лимфоциты общая масса лимфоцитов и их распределение в организме ребенка имеет возрастные различия. Особенно интенсивно увеличивается их масса на первом году жизни, после 6 месяцев их число остается относительно стабильным до 8 лет, затем вновь начинает нарастать. Все лимфоциты прежде чем попасть в кровяное русло проходят через вилочковую железу.
Неспецифические механизмы играют важную роль как у плода, так и у детей первых дней и месяцев жизни. Они включают анатомические барьеры для проникновения инфекции. Это кожа с ее секреторным аппаратом и бактерицидными компонентами секрета потовых и сальных желез, барьеры слизистых оболочек с мукоцилиарным клиренсом в бронхах, моторикой кишечника и мочевыводящих путей. Содержание лизоцима (фермента, разрушающего мукополисахарид бактериальных оболочек) в сыворотке крови к рождению высокое, превышает таковой у взрослых.
Интерфероны продуцируются клетками, первично пораженными вирусами (наиболее активно лейкоцитами), блокируют образование РНК, необходимого для репликации вируса, усиливают фагоцитоз.
Способность к образованию интерферона сразу после рождения высокая, но у детей первого года жизни она снижается, с возрастом постепенно увеличивается, достигая максимума к 1218 годам. Низкий уровень интерферона объясняет повышенную восприимчивость детей раннего возраста к вирусной инфекции.
Фагоцитоз является ранним защитным механизмом плода. Клетки фагоцитарной системы появляются в ранние сроки развития плода от 6 до 12-й недели гестации.
Все время фетального периода лейкоциты обладают низкой способностью к фагоцитозу. Поглотительная способность фагоцитов у новорожденных развита достаточно, но завершающая фаза фагоцитоза формируется в более поздние сроки через 26 месяцев.
Специфический иммунитет осуществляется Т и В-лимфоцитами. Становление всех систем как клеточного, так и неспецифического иммунного ответа начинается при сроках около 23 недель внутриутробного развития, когда формируются мультипотентные стволовые клетки. К 9-15-й неделе появляются признаки функционирования клеточного иммунитета. Реакции гиперчувствительности замедленного типа достигают наибольшего функционирования после рождения к концу первого года жизни. Первичный лимфоидный орган тимус закладывается на сроке около 6 недель, и окончательное гистоморфологическое созревание претерпевает к сроку гестации около 3 месяцев. С 6 недель у плода начинают типироваться HLA антигены, с 89 недели в вилочковой железе появляются малые лимфоциты, под влиянием гуморальных стимулов Т-лимфоциты дифференцируются в цитотоксические клетки, клетки-хелперы, супрессоры, клетки памяти.
В течение первых месяцев жизни продолжаются распад и удаление тех иммуноглобулинов класса G, которые были переданы трансплацентарно. Одновременно происходит нарастание уровней иммуноглобулинов всех классов уже собственного производства. В течение первых 46 месяцев материнские иммуноглобулины полностью разрушаются, и начинается синтез собственных иммуноглобулинов. В-лимфоциты синтезируют преимущественно IgM, уровень которого быстрее достигает показателей, свойственных взрослым, синтез собственного IgG происходит более медленно.
Молозиво и нативное грудное молоко, содержащие большое количество IgA, макрофагов и лимфоцитов, компенсируют незрелость общего и местного иммунитета у детей первых месяцев жизни.
Повышение уровня сывороточных и секреторных иммуноглобулинов к 5 годам совпадает со снижением уровня инфекционной заболеваемости.
3. Общая характеристика вакцин
Все вакцины делятся на живые и инактивированные.
Живые вакцины. К числу живых вакцин относятся вакцины БЦЖ, против кори, краснухи, эпидемического паротита, полиомиелита. Они создаются на основе живых ослабленных микроорганизмов со стойким снижением вирулентности. Вакцинные штаммы, применяемые в производстве живых вакцин, получают путем выделения аттенуированных (ослабленных) штаммов от больных или из внешней среды путем селекции вакцинных клонов и длительного пассивирования в организме экспериментальных животных, а также на клетках куриных или человеческих эмбрионов. Клетки куриных эмбрионов используют, например, для получения вакцины против гепатита В, человеческих против краснухи. Формирующийся в результате иммунизации поствакцинальный иммунитет по напряженности приближается к постинфекционному. Живые вакцины термолабильны, в связи с чем их необходимо хранить и транспортировать при температуре 4 8 °C, соблюдая так называемую «холодовую цепь».
Инактивированные вакцины. Такие вакцины подразделяют на цельноклеточные (корпускулярные), расщепленные (сплит), субъединичные, рекомбинантные и анатоксины.
К цельноклеточным относятся вакцины против полиомиелита, коклюша адсорбированная коклюшно-дифтерийно-столбнячная вакцина (АКДС), гриппа, гепатита А, бешенства. Эти вакцины содержат инактивированные очищенные неразрушенные микроорганизмы, которые получают путем их обезвреживания с помощью химического или физического воздействия. Цельноклеточные вакцины создают нестойкий гуморальный иммунитет, в связи с чем для достижения защитного уровня специфических антител необходимо вводить их повторно.
Цельноклеточные вакцины высокореактогенны.
Расщепленные вакцины (сплиты). К их числу относятся вакцины против гриппа (ваксигрипп, флюарикс). Расщепленные вакцины содержат все фрагментированные очищенные частицы микроорганизмов, разъединенные с помощью детергентов.
Субъединичные вакцины (химические). К субъединичным относятся вакцины против менингококка, пневмококка, гемофильной палочки, брюшного тифа, гепатита В, гриппа (инфлювакс, гриппол). Они содержат лишь поверхностные антигенные фракции инактивированных микроорганизмов, что позволяет уменьшить содержание белка в вакцине и реактогенность.
Рекомбинантные вакцины. Вакцину против гепатита В (энджерикс В) изготавливают с помощью рекомбинантной технологии.
Участок гена микроорганизма, кодирующий синтез протективного антигена, встраивают в ДНК клеток-продуцентов (дрожжи, Escherichia coli), которые, размножаясь, продуцируют данный антиген. Протективный белок выделяют из клеток-продуцентов и подвергают очистке. Рекомбинантные вакцины слабо реактогенны. Развивающийся после вакцинации иммунитет относительно кратковременный.
Анатоксины. Это бактериальные экзотоксины, обезвреженные длительным воздействием формалина при повышенной температуре. Анатоксинами являются вакцины против столбняка, дифтерии, коклюша (инфанрикс), ботулизма, газовой гангрены. Анатоксины мало реактогенны. Так, при введении коклюшного анатоксина (в составе комплексной вакцины ифанрикс) лихорадка возникает реже в 7 раз, а болезненность в месте введения в 14 раз,
чем при введении с цельноклеточной коклюшной вакцины. Однако при введении анатоксинов вырабатывается только антитоксический иммунитет, в связи с чем они не предотвращают бактерионосительства.
Моновакцины и комбинированные вакцины. В зависимости от числа антигенов, входящих в состав вакцин, они подразделяются на моновакцины и комбинированные (ассоциированные) вакцины.
Моновакцины содержат антиген против одного возбудителя, комбинированные против нескольких видов микроорганизмов.
Моновакцины подразделяются на моновалентные (содержат антиген против одного серотипа или штамма возбудителя) и поливалентные (содержат антигены против нескольких серотипов или штаммов одного и того же микроорганизма).
К поливалентным вакцинам относятся менинго А+ С, пневмо 23, имовакс Д. Т. полио (инактивированная трехвалентная полиомиелитная вакцина), живая трехвалентная полиомиелитная вакцина.
Примерами комбинированных вакцин являются АКДС-вакцина, адсорбированный дифтерийно-столбнячный (АДС) и АДС-М (малый) анатоксины.
Состав вакцин. В состав вакцин помимо антигенов, обеспечивающих развитие специфического иммунитета, входят стабилизаторы (вносимые в препарат для обеспечения стабильности его антигенных свойств), консерванты (поддерживающие стерильность вакцины) и адъюванты (повышающие иммуногенность препарата).
В качестве стабилизаторов используются сахароза, лактоза, альбумин человека, натрия глутамат.
Наиболее распространенным консервантом как в России, так и за рубежом является мертиолат (тиомерсал) органическая соль ртути. Мертиолат содержится в АКДС-вакцине, анатоксинах, вакцине против гепатита В и др. Его содержание в указанных препаратах не превышает 50 мкг в одной дозе. Помимо мертиолата в качестве консервантов используют формальдегид, фенол, феноксиэтанол и антибиотики (неомицин, канамицин, полимиксин).
Кроме того, в состав вакцин включаются вещества технологии производства (гетерологичные белки субстрата культивирования, компоненты питательной среды, цитокины). Так, в следовых количествах в коревой вакцине может содержаться сыворотка крупного рогатого скота, в паротитной белки яйца (перепелиного в отечественных вакцинах, куриного в зарубежных), в вакцине против гепатита В следы дрожжевых белков.
Вещества, не определяющие иммуногенность вакцины, могут являться источником побочного действия (токсического, генотоксического, аутоиммунного, аллергического).
4. Методика вакцинации
4.1. Календарь профилактических прививок
Календарь профилактических прививок, или график иммунизации, это инструктивно закрепленная возрастная последовательность прививок, обязательных в данной стране, что определяется конкретной эпидемиологической ситуацией. В России обязательными являются прививки против девяти инфекций (приказ Минздрава России от 27 июня 2001 г. № 229 «О национальном календаре профилактических прививок и календаре профилактических прививок по эпидемическим показаниям» с изменениями от 30 октября 2007 г. № 673) (см. Приложение 1)
Национальный календарь профилактических прививок у детей
|
Возраст |
Наименование прививки |
|
Первые 12 часов жизни |
Гепатит В (первая вакцинация) |
|
3 7сутки |
Туберкулез (вакцинация) |
|
3 месяца |
вакцинация). Гепатит В (вторая вакцинация) |
|
4,5 месяца |
Дифтерия, коклюш, столбняк, полиомиелит (вторая вакцинация) |
|
6 месяцев |
Дифтерия, коклюш, столбняк, полиомиелит (третья вакцинация). Гепатит В (третья вакцинация) |
|
12 месяцев |
Корь, краснуха, паротит (вакцинация) |
|
18 месяцев |
Дифтерия, коклюш, столбняк, полиомиелит (первая ревакцинация) |
|
20 месяцев |
Полиомиелит (вторая ревакцинация) |
|
6 лет |
Корь, краснуха, паротит (вторая вакцинация) |
|
7 лет |
Туберкулез (первая ревакцинация). Дифтерия, столбняк (вторая ревакцинация) |
|
13 лет |
Краснуха (для девочек) (вакцинация). Гепатит В (вакцинация ранее не привитые) |
|
14 лет |
Дифтерия и столбняк (третья ревакцинация). Туберкулез (ревакцинация). Полиомиелит (третья ревакцинация) |
К Национальному календарю профилактических прививок приведены комментарии.
1. Иммунизация в рамках Национального календаря профилактических прививок проводится вакцинами отечественного и зарубежного производства, зарегистрированными и разрешенными к применению в соответствии с инструкциями.
2. Детям, родившимся от матерей носителей вируса гепатита В или заболевших вирусным гепатитом В в третьем триместре беременности, вакцинация против гепатита В проводится по схеме: 0 1 2 12 мес.
3. Вакцинация против гепатита в 13 лет проводится ранее не привитым по схеме: 0 1 6 мес.
4. Вакцинация против краснухи проводится девочкам в 13 лет, ранее не привитым или получившим только одну прививку.
5. Ревакцинация против туберкулеза проводится не инфицированным микобактериями туберкулеза туберкулинотрицательным (по результатам пробы Манту) детям.
6. В 14 лет ревакинация проводится неинфицированным детям (туберкулиноотрицательным), не получившим прививку в 7 лет.
7. Все вакцины, кроме БЦЖ, можно вводить одновременно разными шприцами в разные участки тела или с интервалом в 1 мес.
8. При нарушении срока начала прививок их проводят по схемам, предусмотренным настоящим календарем и инструкциями по применению препаратов.
9. Детям 1-го года жизни вакцинация против полиомиелита проводится инактивированной вакциной.
4.2. Правила проведения вакцинации
Перед прививкой врач должен проанализировать данные эпидемиологического анамнеза (сведения о контактах с инфекционными больными), тщательно осмотреть ребенка, измерить температуру тела. Лабораторное обследование и консультации специалистов (невропатолога и др.) проводятся по показаниям. Они особенно важны для детей в возрасте 3 мес перед началом вакцинации против коклюша, дифтерии, столбняка, полиомиелита. К моменту начала вакцинации у ребенка не должно быть противопоказаний к ее проведению, в том числе не должно быть острых заболеваний и обострений хронических. Врач делает в медицинской документации запись о разрешении проведения вакцинации конкретным препаратом. После введения указывают дату введения препарата и серию вакцины. Прививки рекомендуется проводить в утреннее время в положении сидя или лежа. Для профилактики анафилактического шока ребенок после прививки должен находиться под наблюдением врача в течение 30 мин, а сами прививки должны проводиться в условиях процедурного кабинета, где находится противошоковый набор. Родителей необходимо предупредить о возможных реакциях после введения вакцины, а также о действиях при их возникновении (детям следует дать жаропонижающие, антигистаминные препараты). До и после прививки ребенка необходимо оберегать от стрессов, контакта с инфекционными больными, не вводить новые
продукты прикорма. У детей 1-го года жизни на следующий день после прививки проводится патронаж; после вакцинации против полиомиелита грудного ребенка осматривают на 2-е и 7-е сутки.
4.3. Способы введения вакцин
Существуют разные способы введения вакцин. Даже разные вакцины против одного и того же заболевания вводят по-разному. Например, живая вакцина против полиомиелита вводится внутрь, инактивированная внутримышечно. При этом класс синтезируемых антител тоже различен. При введении живой вакцины в большей степени синтезируется IgA, при введении инактивированной IgM и IgG. В соответствии с этим в первом случае доминирует местный, во втором системный иммунный ответ. Рекомендуется сочетать введение вакцин у одного и того же ребенка: начинать с инактивированной вакцины, затем переходить на живую.
Живые вакцины (коревая, паротитная, краснушная) предпочтительно вводить подкожно из-за меньшей болезненности и большей безопасности.
При внутримышечном введении вакцины нужно исключать вероятность повреждения нервов и кровеносных сосудов. Согласно современным инструкциям по применению отечественных сорбированных вакцин (АКДС, АДС, АДС-М, против гепатита В) местом внутримышечного введения является верхний наружный квадрант ягодицы или переднебоковая область верхней части бедра. Однако накоплено большое количество сведений о том, что введение любых иммунных препаратов в ягодичную область чревато опасностью повреждения седалищного нерва с возникновением длительно сохраняющейся мышечной слабости, контрактуры, провисания стопы и замедления роста конечности на стороне повреждения. В результате небрежного выполнения манипуляции или при аномальном расположении нервов и сосудов возможно повреждение других нервов, иннервирующих ягодичную область или проходящих через нее (верхний ягодичный нерв, задний бедренный кожный, половой, нижний ягодичный нервы). Поэтому в
зарубежной практике внутримышечно детям до 18 мес жизни вакцину вводят в переднебоковую область верхней части бедра, детям старше 18 мес в область дельтовидной мышцы.
Отказ от введения вакцины в ягодицу помимо возможности повреждения нервов и сосудов, проходящих в области ягодицы, мотивируется также и тем, что у детей раннего возраста ягодичная область состоит преимущественно из жировой ткани, а четырехглавая мышца бедра хорошо развита с первых месяцев жизни. Кроме того, в переднебоковой области верхней части бедра нет
важных нервов и кровеносных сосудов. У детей в возрасте старше 2 3 лет вакцину предпочтительнее вводить в дельтовидную мышцу (посредине между латеральным концом ости лопатки и дельтовидной бугристостью). Инъекций в
трехглавую мышцу необходимо избегать из-за возможности травмирования лучевого, плечевого и локтевого нервов, а также глубокой артерии плеча.
4.4. Противопоказания к вакцинации
Противопоказания к вакцинации разделяют на постоянные (абсолютные) и временные (относительные).
Абсолютно противопоказаны:
Все вакцины в случае чрезмерно сильных реакций или других поствакцинальных осложнений на предыдущее введение;
Все живые вакцины лицам с иммунодефицитными состояниями (первичными); иммуносупрессией, злокачественными новообразованиями; беременным женщинам;
БЦЖ-вакцина при массе тела ребенка при рождении менее 2000 г; келоидных рубцах, в том числе после введения предыдущей дозы;
АКДС-вакцина при прогрессирующих заболеваниях нервной системы, афебрильных судорогах в анамнезе;
Живые коревая, паротитная, краснушная вакцины при тяжелых формах аллергических реакций на аминогликозиды; анафилактических реакциях на яичный белок (кроме краснушной вакцины);
Вакцина против вирусного гепатита В при аллергических реакциях на пекарские дрожжи.
При временных противопоказаниях плановая вакцинация откладывается до окончания острых и обострений хронических заболеваний Вакцина вводится не ранее чем через 4 недели после выздоровления.
5. Вакцинальные реакции и осложнения
5.1. Вакцинальные реакции
Нормальная вакцинальная реакция. Вакцинальный процесс обычно протекает бессимптомно, но у привитых лиц возможны проявления нормальной вакцинальной реакции, под которой понимают клинические и лабораторные изменения, связанные со специфическим действием той или иной вакцины. Клинические проявления и частота их возникновения описываются в инструкции к каждому медицинскому иммунобиологическому препарату. Таким образом, вакцинальные реакции это комплекс клинических и параклинических проявлений, стереотипно развивающийся после введения конкретного антигена и определяющийся реактогенностью вакцины.
Наряду с нормальной вакцинальной реакцией введение вакцин может сопровождаться побочными эффектами. Патологические состояния, возникающие в поствакцинальном периоде, подразделяют на три группы:
1) присоединение острой интеркуррентной инфекции или обострение хронических заболеваний;
2) поствакцинальные реакции;
3) поствакцинальные осложнения.
У детей после введения вакцин могут возникать неспецифические (по отношению к вакцине) инфекционные заболевания: острые респираторные вирусные инфекции (ОРВИ) (нередко с проявлениями нейротоксикоза, синдрома крупа, обструктивного бронхита), пневмония, инфекция мочевых путей, нейроинфекция и др. Как правило, повышенную инфекционную заболеваемость в поствакцинальном периоде объясняют простым совпадением во времени прививки и болезни. Однако она может быть связана и с изменениями в иммунной системе после введения вакцин. Это обусловливается тем, что при введении вакцин в иммунной системе возникают однотипные двухфазные изменения.
Первая фаза иммуностимуляции сопровождается увеличением числа циркулирующих лимфоцитов, в том числе Т-хелперов и В-лимфоцитов.
Вторая фаза транзиторного иммунодефицита развивается через 2 3 недели после введения вакцины и характеризуется снижением численности всех субпопуляций лимфоцитов и их функциональной активности, в том числе способности отвечать на митогены и синтезировать антитела. Эта фаза необходима для ограничения иммунного ответа на антигены вакцины.
Патогенетически поствакцинальный иммунодефицит неотличим от вторичных иммунодефицитов, возникающих в ходе вирусных или бактериальных инфекций, и именно он лежит в основе повышенной инфекционной заболеваемости неспецифическими (по отношению к вакцине) инфекциями. В поствакцинальном периоде у детей чаще, чем в другое время, регистрируются различные острые инфекции, при этом отмечается два пика: в первые 3 суток и на 10 30-е сутки после вакцинации.
К этой же группе можно отнести осложнения, развивающиеся в результате нарушении техники вакцинации. К числу крайне опасных относится нарушение стерильности вакцин. Это является причиной развития гнойно-септических осложнений, в отдельных случаях завершающихся развитием инфекционно-токсическогошока и летальным исходом.
Патологические поствакциналъные реакции. У некоторых детей при проведении профилактической прививки возникают клинические расстройства, несвойственные обычному течению вакцинального процесса. Такие патологические вакцинальные реакции делят на местные и общие.
К местным патологическим вакцинальным реакциям относят все реакции, возникающие в месте введения вакцины. Неспецифические местные реакции появляются в 1-е сутки после прививки в виде гиперемии и отека, сохраняющихся в течение 24 48 ч. При применении адсорбированных препаратов, особенно подкожно, в месте введения может сформироваться инфильтрат. При повторном введении анатоксинов могут развиться чрезмерно сильные местные аллергические реакции, распространяющиеся на всю ягодицу, а иногда захватывающие поясницу и бедро.
Различают три степени выраженности местной реакции.
Слабой реакцией считается гиперемия без инфильтрата или инфильтрат диаметром до 2,5 см;
средней реакцией инфильтрат до 5 см;
сильной реакцией инфильтрат свыше 5 см, а также инфильтрат с лимфангиитом и лимфаденитом.
В основе появления таких реакций лежит повышение сосудистой проницаемости, а также развитие базофильной инфильтрации под действием адъюванта. При их возникновении назначают антигистаминные препараты, компрессы.
При введении живых бактериальных вакцин развиваются специфические местные реакции, обусловленные инфекционным процессом в месте аппликации препарата. Так, при внутрикожной иммунизации вакциной БЦЖ в месте введения через 6 8 недель развивается специфическая реакция в виде инфильтрата диаметром 5 1 0 мм с небольшим узелком в центре и образованием корочки; в ряде случаев на месте введения возникают пустулы. Обратное развитие изменений занимает 2 4 мес. На месте реакции остается поверхностный рубчик 3 10 мм. При возникновении местной атипичной реакции ребенок нуждается в консультации фтизиатра.
Общие вакцинальные реакции сопровождаются изменением состояния и поведения ребенка. Они нередко выражаются повышением температуры тела, беспокойством, нарушением сна, анорексией, миалгией.
После введения инактивированных вакцин общие реакции развиваются спустя несколько часов; их продолжительность обычно не превышает 48 ч. Тяжесть реакции оценивается по высоте температуры тела, с которой прямо связаны и другие проявления.
Реакция считается слабой при повышении температуры тела до 37,5 °C, средней при температуре от 37,6 до 38,5 °C, сильной при повышении температуры тела более 38,5 °C.
В основе этих проявлений лежит развитие ответа острой фазы. У детей с перинатальным поражением нервной системы после вакцинации может развиться энцефалическая реакция, сопровождающаяся повышением температуры тела и кратковременными судорогами. Проявлением такой реакции на введение противококлюшной вакцины является также непрерывный пронзительный крик ребенка в течение нескольких часов. Механизм развития энцефалической реакции обусловлен повышенной проницаемостью сосудистой стенки, следствием чего является повышение внутричерепного давления и развитие отека головного мозга.
Чаще всего энцефалические реакции развиваются после вакцинации цельноклеточной противококлюшной вакциной, что связано с ее сенсибилизирующим действием, наличием перекрестно реагирующих с тканью головного мозга антигенов. Вместе с тем частота судорог после вакцины АКДС ниже, чем у зарубежных аналогов.
Терапия энцефалических поствакцинальных реакций аналогична терапии, проводимой при нейротоксикозе. К проявлениям общих реакций на вакцинацию относится и аллергическая сыпь. При ее возникновении показаны антигистаминные препараты.
5.2. Поствакцинальные осложнения
В соответствии с Федеральным законом от 17 сентября 1998 г. № 157-ФЗ «Об иммунопрофилактике инфекционных болезней» к поствакцинальным осложнениям относят тяжелые и(или) стойкие нарушения состояния здоровья, развивающиеся вследствие профилактических прививок.
Поствакцинальные осложнения разделяют на специфические, зависящие от вида микроорганизма, содержащегося в составе вакцины, и неспецифические.
Специфические поствакцинальные осложнения. Среди таких осложнений выделяют вакциноассоциированные инфекции, обусловленные остаточной вирулентностью вакцинного штамма, реверсией его патогенных свойств и нарушениями в иммунной системе (первичные иммунодефициты).
Персистирующая и генерализованная БЦЖ-инфекция проявляется развитием остеитов (протекающих как костный туберкулез), лимфаденитов (двух и более локализаций), подкожных инфильтратов.
При генерализованной инфекции наблюдаются полиморфные клинические проявления. У лиц с первичными комбинированными иммунодефицитами возможен летальный исход.
При развитии БЦЖ-инфекции проводят этиотропную терапию. При генерализованной БЦЖ-инфекции на 2 3 мес назначают изониазид или пиразинамид. При гнойном лимфадените делают пункцию пораженного лимфатического узла с удалением казеозных масс и вводят стрептомицин или другие противотуберкулезные препараты в дозе, соответствующей возрасту. Та же терапия показана при холодных абсцессах, развившихся вследствие нарушения техники вакцинации и подкожном введении вакцины БЦЖ.
Осложнения после вакцинации БЦЖ развиваются редко. Так, регионарный БЦЖ-лимфаденит регистрируется с частотой 1:10 000, генерализованная БЦЖ-инфекция 1:100 000.
Диагноз «вакциноассоциированный полиомиелит» ставится на основании критериев, предложенных ВОЗ:
а) возникновение в сроки от 4-х до 30-х суток у привитых, до 60 сут у контактных;
б) развитие вялых параличей или парезов без нарушения чувствительности и с остаточными явлениями после истечения 2 мес болезни;
в) отсутствие прогрессирования заболевания;
г) выделение вакцинного штамма вируса и нарастание титра типоспецифических антител не менее чем в 4 раза.
В странах с широким охватом вакцинацией большинство случаев полиомиелита в современных условиях могут быть расценены как вакциноассоциированные. Вакциноассоциированный полиомиелит встречается у одного ребенка из 500 000 привитых детей оральной полиомиелитной вакциной. В России с 1997 г. Ежегодно отмечают от 2 до 11 случаев вакциноассоциированного полиомиелита, что в среднем не выходит за рамки международной
статистики.
Такое осложнение, как энцефалит, при вакцинации как инактивированными,
так и живыми вакцинами встречается в соотношении 1:1 000 000.
Митигированная корь, поствакциналъный коревой энцефалит, подострый склерозирующий панэнцефалит и коревая пневмония могут возникнуть после вакцинации коревой вакциной.
Острый паротит и паротитный менингит развиваются после вакцинации паротитной вакциной.
Артрит и артралгии могут возникнуть после введения краснушной вакцины; синдром врожденной краснухи, прерывание беременности при вакцинации беременных краснушной вакциной.
Неспецифические поствакцинальные осложнения. Такие осложнения связаны прежде всего с индивидуальной реактивностью прививаемого. Вакцинация может выступать в качестве фактора выявления генетической предрасположенности прививаемого, а сами поствакцинальные осложнения у маленьких детей являются предикторами развития в последующем иммунопатологических заболеваний. По ведущему механизму возникновения данные осложнения условно можно разделить на три группы: аллергические
(атопические), иммунокомплексные, аутоиммунные.
К аллергическим осложнениям относятся анафилактический шок, тяжелые генерализованные аллергические реакции (отек Квинке, синдром СтивенсаДжонсона, синдром Лайелла, многоморфная экссудативная эритема), начало и обострения атопического дерматита, бронхиальной астмы.
Аллергия, возникающая при вакцинации, связана с повышенной выработкой общего и специфических IgE как к протективным антигенам вакцины, так и к антигенам, не обладающим протективным действием (белок яйца, антибиотики, желатин). Аллергические реакции возникают в большей степени у предрасположенных к атопии лиц. Единичные случаи сильных местных (в том числе отек, гиперемия более 8 см в диаметре) и общих (в том числе температура более 40 °C, фебрильные судороги) реакций на вакцинацию, а также легкие проявления кожной и респираторной аллергии подлежат регистрации в установленном порядке без информирования вышестоящих органов здравоохранения.
Самым тяжелым осложнением группы является анафилактический шок.
Вакцинация может приводить к инициации и(или) обострению иммунокомплексных и аутоиммунных заболеваний. К первым относятся геморрагический васкулит, сывороточная болезнь, узелковый полиартериит, гломерулонефрит, идиопатическая тромбоцитопеническая пурпура.
Аутоиммунный механизм имеют поствакцинальные осложнения с поражением центральной и периферической нервной системы. Поражение ЦНС выражается в развитии энцефалита, энцефаломиелита.
При поражении периферической нервной системы могут возникнуть мононеврит, полиневрит, синдром Гийена Барре. Помимо этого в качестве осложнений вакцинации развиваются «вторые» болезни: аутоиммунная гемолитическая анемия, идиопатическая и тромботическая тромбоцитопеническая пурпура, миокардит, гломерулонефрит, тубулоинтерстициальный нефрит, системная красная волчанка (СКВ), дерматомиозит, системная склеродермия, ювенильный ревматоидный артрит, рассеянный склероз. Введение вакцин может стимулировать образование аутоантител, аутореактивных лимфоцитов, иммунных комплексов. Одновременно с этим в сыворотке крови привитых детей повышается содержание провоспалительных цитокинов (ИЛ-1, ИЛ-6, ФНОа). Это обычно возникает при введении больших доз некоторых вакцин.
Индукция аутоиммунных реакций при вакцинации связана с феноменом антигенной мимикрии, наличием перекрестных антигенных структур между вакциной и собственными тканями организма, а также наличием в составе вакцин химических адъювантов, эндотоксина, цитокинов и нефизиологическим (парентеральным) введением антигена в сравнении с естественной инфекцией.
Риск развития данных заболеваний повышен у предрасположенных лиц. Вместе с тем достоверные доказательства связи перечисленных заболеваний с вакцинацией получить трудно. Их дифференциальная диагностика с аутоиммунными заболеваниями, латентно протекающими до прививки и манифестирующими в поствакцинальный период, чрезвычайно сложна. Полагают, что прививки служат не причиной, а скорее условием, благоприятствующим развитию указанных заболеваний. Вместе с тем анализ патогенетических механизмов формирования таких состояний доказывает принципиальную возможность и биологическую правдоподобность их развития.
PAGE \* MERGEFORMAT 26